Принципы и использование дифузионно-взвешеного сканированния в выявлении рака, стадировании и контроле лечения
Введение
Диффузионно-взвешенная визуализация использовалась для выявления ранних инсультов и других неврологических заболеваний с 1990-х годов. С того времени все большее число исследований продемонстрировали полезность этого метода как для обнаружения, так и для характеристики повреждений, более конкретно, в области онкологической визуализации. Применение диффузионно-взвешенной последовательности при визуализации всего тела приобрело большую популярность благодаря новым техническим разработкам в области магнитно-резонансного (МР) изображения, включая многоканальные катушки, эхопланарную визуализацию и более сильные градиенты [1], что привело к уменьшению количества времени, необходимого для диффузионно-взвешенной визуализации менее 1 минуты. Поэтому эти последовательности могут быть добавлены к протоколу визуализации без значительного увеличения общего времени сбора. Другим преимуществом диффузионно-взвешенной визуализации является ее использование присущего тканевого контраста; Следовательно, экзогенный контрастный материал не требуется. Вышеупомянутые улучшения и растущий объем исследований привели к все большему использованию диффузионно-взвешенной визуализации для конкретных применений, включая онкологическую визуализацию печени [2], предстательной железы [3] и груди [4], а также Как изображение всего тела [5].
В этой статье мы рассмотрим принципы отображения диффузионно-взвешенных изображений (DWI) и измеряемого коэффициента диффузии (ADC) в качестве биомаркера изображений для определения характеристик ткани, выявления и постановки рака, а также оценки ответа на лечение.
Чтобы понять концепцию диффузионно-взвешенной визуализации, нужно понимать принципы свободной и ограниченной диффузии в клеточном микроокружении. Свободные молекулы воды находятся в постоянном случайном движении, известном как броуновское движение, которое связано с тепловой кинетической энергией. Напротив, движение молекул воды в клеточном микроокружении затруднено их взаимодействием с клеточными компартментами, включая клеточную стенку и внутриклеточные органеллы [6]. Другими словами, ограничение диффузии молекул воды прямо пропорционально степени клеточности ткани. Эта ограниченная диффузия наблюдается прежде всего в злокачественных новообразованиях, гиперклеточных метастазах и фиброзе, которые содержат большее количество клеток с интактными клеточными стенками, чем здоровая ткань (рис. 1). Напротив, в микроокружении с меньшим количеством клеток и дефектной клеточной мембраной (например, некротическим центром большой образования) молекулы воды могут свободно перемещаться (т. е. диффузия менее ограничена) [1].
NB данная статья является авторским переводом публикации Malayeri AA, El Khouli RH, Zaheer A, Jacobs MA, Corona-Villalobos CP, Kamel IR, Macura KJ. Principles and applications of diffusion-weighted imaging in cancer detection, staging, and treatment follow-up. Radiographics : a review publication of the Radiological Society of North America, Inc. 31 (6): 1773-91. [51]
Принцыпы диффузионно-взвешенного сканирования
Связь между степенью клеточности и ограниченной диффузией
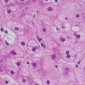
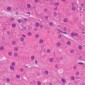
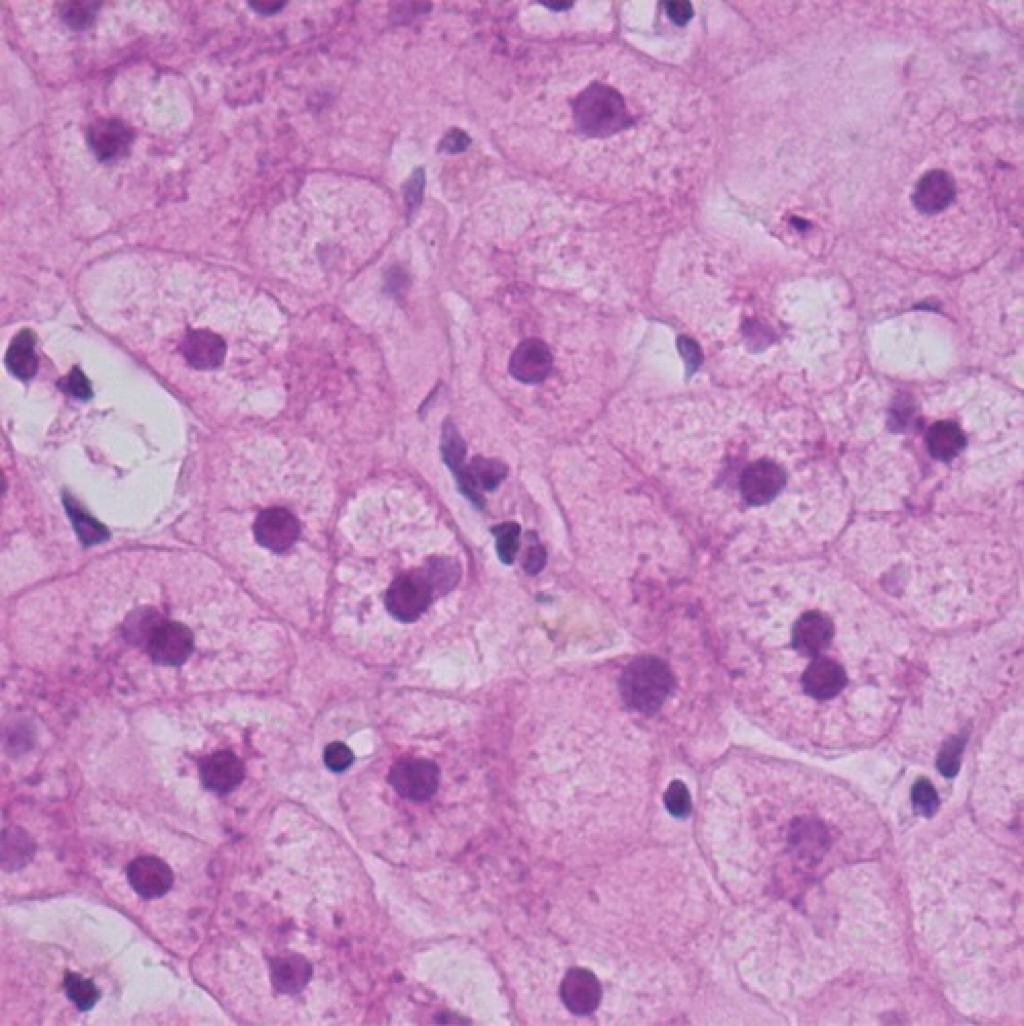
Высокомощная микрофотография (первоначальное увеличение, × 400, окраска гематоксилин-эозин) нормальной паренхимы печени демонстрирует обильное пространство для движения молекул воды (Рис 1).
Высокомощная микрофотография (первоначальное увеличение, 400, гематоксилин-эозин), гепатоцеллюлярная карцинома, показывает большее количество клеточных элементов, что приводит к меньшему пространству для движения молекул воды. (Courtesy of Hui Guan, MD, Johns Hopkins Medical Institutions, Baltimore, Md.) (Рис 2)
Методы обработки изображений с диффузионной взвешиванием:
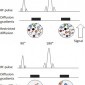
Наиболее распространенным методом, используемым для диффузионно-взвешенной визуализации, является включение двух симметричных градиентных импульса движения в одну взвешенную по спиновому эхо (SE) Т2-взвешенную последовательность, по одной с обеих сторон 180 ° - фокусирующего импульса (последовательность Stejskal-Tanner) (Рис 3). Это можно объяснить на молекулярном уровне тем, что градиент диффузии приводит к изменению фазового сдвига в зависимости от положения, при этом все спины остаются в одном и том же месте (т. е. ограниченное диффузионное микроокружение) вдоль оси градиента в течение двух импульсов, возвращающихся в их начальное состояние. Однако спины, который сдвинулись (т. е. молекулы свободной воды) будут подвергаться другой напряженности поля во время второго импульса и поэтому не вернутся в исходное состояние, но вместо этого будут подвергаться полному фазовому сдвигу, что приведет к уменьшению интенсивности Измеренный MR-сигнал [7]. Степень ослабления сигнала зависит от множества факторов, как показано в следующем уравнении:
SI = SI0 x exp (-b x D),
Где SI0 - интенсивность сигнала взвешенного T2 изображения без применения градиента диффузии, b - степень диффузионного взвешивания (значение b), а D - коэффициент диффузии [5].
Чувствительность диффузионно-взвешенной визуализации к диффузии может быть постепенно увеличена за счет увеличения амплитуды, продолжительности и временного интервала двух градиентов движения. Эти свойства градиента определяют значение b (выраженное в секундах на квадратный миллиметр), показатель степени диффузионного взвешивания (Рис 3).
В клинической практике для уменьшения ошибки в расчете ADC для улучшения характеристики ткани (Рис 4-6) используются несколько значений b.
Количественный анализ с диффузионно-взвешенной визуализацией - ADC картирование
ADC рассчитывается во время постобработки с использованием по меньшей мере двух разных значений b. Значение ADC представляет собой наклон линии, которая накладывается на график логарифма относительной интенсивности сигнала (по оси Y) по сравнению с значением b (ось x) (Рис 7). Более точное значение ADC можно получить, используя большее количество изображений с диффузионным взвешиванием с разными значениями b. Конечное изображение с разными значениями ADC, вычисленными для каждого пикселя изображения, называется картой ADC. Путем рисования областей, представляющих интерес в пределах поражения, можно определить значение ADC для поражения. Области с более ограниченной диффузией и, следовательно, более высокий диффузионно-взвешенный сигнал показывают более низкие значения ADC (8). Важно помнить, что карты ADC имеют плохую анатомическую детализацию и должны анализироваться в сочетании с другими МР-изображениями, включая различные изображения с увеличенной амплитудой b-значения, анатомические изображения с более высоким разрешением и, при наличии, изображения с контрастным усилением.
Артефакты и ловушки диффузионно-взвешенной визуализации:
Эффект T2-просвечивания (см так же отдельную статью)
При диффузионно-взвешенной визуализации, используется T2 SE-последовательность, а интенсивность сигнала ткани зависит как от сигнала T2, так и от степени затухания сигнала после применения импульсов градиента движения. Поэтому в тканях с очень длинными временами релаксации Т2 сильный сигнал Т2 можно ошибочно принять за ограниченную диффузию, явление, известное как эффект Т2-просвечивания. Самый простой способ отличить ограниченную диффузию от T2 shine-through - создать карту ADC, на которой первая появляется как область с низкой интенсивностью сигнала (низкие значения ADC), а вторая - как область с высокой интенсивностью сигнала (Рисунки 9-11). Существуют и другие способы уменьшения T2-просвечивания, такие как использование (a) высокого значения b и короткого времени эха для уменьшения сигнала T2 или (b) метод экспоненциального изображения, в котором создается новое изображение с использованием диффузионно-взвешенного изображения, деленное на невзвешенное изображение (b = 0). Этот расчет основан на приведенном ранее уравнении ослабления сигнала (см. «Методика взвешивания с использованием диффузии»).
Артефакт восприимчивости
Эхопланарная последовательность используется для получения изображений с диффузионно взвешенным изображением и особенно восприимчива к неоднородностям магнитного поля. Использование эхопланарной последовательности при абдоминальной визуализации особенно сложно из-за присутствия воздуха в желудочно-кишечном тракте и легких [9]. Другие источники артефактов восприимчивости включают медицинские устройства (например, металлические стенты, хирургические зажимы) и трансплантаты. Один из способов уменьшить артефакт восприимчивости - сократить время эха и увеличить пропускную способность.
Артефакт движения
Артефакт движения из-за множественных постоянно движущихся органов является основным источником снижения качества изображения при дифузионно-взвешенной визуализации всего тела. Артефакт движения более выражен вдоль направления фазового кодирования, где он создает изображения - призраки. Поэтому сгенерированный сигнал не ограничивается исходным вокселом и распространяется по всему изображению, создавая потенциальную ошибку в оцененных значениях ADC. Увеличение скорости захвата изображения, которое теперь возможно при однократном эхопланарном изображении, и использование параллельного изображения - возможные способы уменьшения этого артефакта.
Эффект контрастного материала
При проведении дифузионно-взвешенной визуализации всего тела необходимо учитывать влияние контрастного материала на количественную оценку параметров диффузии, в частности на значения ADC. Этот эффект, по-видимому, наиболее выражен в почечной паренхиме из-за высокой концентрации контрастного вещества и парамагнитных эффектов контрастного вещества, выводимого в ЧЛС. В недавнем исследовании 50 пациентов, Wang и др. [10] продемонстрировали, что сигнал ADC почечной паренхимы значительно ниже на снимках с постконтрастной диффузией (полученные в среднем через 11 минут после инъекции контрастного материала), чем на преконтрастных изображениях. Не обнаружено существенного снижения значений ADC для печени, поджелудочной железы или селезенки после инъекции [10].
Приминение диффузионно-взвешенной визуализации:
Исследование молочной железы
Диффузионно-взвешенное изображение впервые было представлено в области МР-томографии груди более 2-х десятилетий лет назад, но только в 2002 году Sinha и др. [4] продемонстрировали, что среднее значение ADC нормальных тканей и доброкачественных поражений выше, чем у злокачественных поражений (Рис 11-13). Тем не менее, оптимальный диапазон значений b для оценки злокачественных опухолей молочной железы остается критическим вопросом. Было предложено несколько комбинаций значений b для точной дифференцировки доброкачественных и злокачественных поражений, дающих разные рассчитанные значения ADC (Рис 14) [11-13]. В двух исследованиях было сопоставлено использование нескольких комбинаций значений b. В первом исследовании было сделано заключение о том, что не было существенной разницы в диагностической полезности значений ADC, полученных с различными комбинациями значений b; Однако исследование показало, что значения ADC, рассчитанные с использованием значений b 0 и 750 с / мм2, были несколько более полезными, чем значения, рассчитанные с использованием других комбинаций [14]. Другое исследование показало, что использование значений b 50 и 850 с / мм2 привело к максимальной точности (95%) [15]. Недавнее исследование Pereira и соавт. [12] показало, что оптимальное значение отсечки ADC для дифференцировки злокачественных от доброкачественной ткани было различным для разных комбинаций значений b (Рис 14).
Роль значения ADC в дифференцировке доброкачественных от злокачественных образований молочных желез хорошо установлена. Недавнее исследование показало, что, когда используются значения b от 0 до 1000 с / мм2, значения ADC показывают обратную зависимость от уровня опухоли с менее агрессивными опухолями (то есть 1-й степени и поражениями in situ), показывающими среднее значение ADC 1,19 × 10-3 мм2 / сек и более агрессивные опухоли (т. е. поражения 2 и 3 степени), показывающие среднее значение ADC 0,96 × 10-3 мм2 / сек [16]. Другое исследование показало, что среднее значение ADC инвазивной протоковой карциномы молочной железы значительно коррелировало с экспрессией рецепторов эстрогена и рецептора 2 эпидермального фактора роста человека [13].
Нормализация значений ADC повреждений молочной железы у пациентов с ипсилатеральной удаленной железистой тканью [13] показала перспективность, помогая минимизировать влияние (а) изменений в значении ADC в течение менструального цикла, которые были предложены ранее в литературе [17], И (б) изменения используемых параметров сканирования. Использование нормализованного значения ADC привело к значительному улучшению диагностической эффективности диффузионно-взвешенной визуализации при распознавании доброкачественных и злокачественных образований. В литературе была предложена нормализованная точка отсечения ADC 0,7 для лучшей характеристики ткани.
Диффузионно-взвешенная визуализация груди показала перспективность для оценки реакции опухоли на неоадъювантную химиотерапию. Различные отчеты показали, что значение ADC было более полезным при оценке ответа опухоли после первого цикла неоадъювантной химиотерапии и позднего ответа опухоли после третьего цикла, чем морфологические параметры, такие как объем опухоли и параметры МР-изображения с улучшенным контрастом [18]. В исследовании, проведенном в 2009 году у пациентов с локально распространенным раком молочной железы, Sharma и др. [18] сообщили о среднем увеличении значения ADC 51% ± 31,5 у респондентов по сравнению с 14,3% ± 13,1 у нереспондентов, и они предложили величину отсечки 15,7% после второго цикла (чувствительность = 81%, специфичность = 88%, площадь под кривой ROC = 0,93) и увеличенное значение отсечки 23,8% после третьего цикла (чувствительность = 79%, специфичность = 80%, площадь под кривой ROC = 0,87), чтобы дифференцировать пациентов, которые ответили на неоадъювантную химиотерапию с теми, кто не отреагировал. В своем исследовании пациентов с раком молочной железы Park et al [19] сообщали о подобных значениях, при среднем значении ADC 47,9 ± 4,8 у респондентов по сравнению с 18,1 ± 4,5 у неответчиков. Недавние сообщения исследовали полезность значений ADC для предварительной обработки при прогнозировании реакции опухоли на неоадъювантную химиотерапию. Park и др. [19] пришли к выводу, что значение ADC для предварительной обработки у респондентов было значительно ниже, чем у нереспондентов, и они предложили значение отсечки 1,17 × 10-3 мм2 / сек (чувствительность = 94%, специфичность = 71%, площадь под кривой ROC = 0,89).
Исследование печени
Недавние исследования показали, что изображение с диффузионно-взвешенным изображением превосходит T2-взвешенное изображение при обнаружении новых повреждений печени [20]. Изображения с низким значением b, на которых подавляется фоновый сигнал крови, лучше способны выявлять поражения печени, чем изображения, полученные при значении b - 0 [21], тогда как последовательность с более высоким b-значением дает лучшую характеристику повреждений (Рис 15-17). В недавнем исследовании 53 пациентов Parikh et al [20] обнаружили, что чувствительность диффузионно-взвешенной визуализации (b = 50 с / мм2) для обнаружения поражений печени была значительно выше, чем чувствительность стандартных Т2-взвешенных изображений с задержкой дыхания (87,7% против 70,1%). Процент злокачественных очаговых поражений печени, обнаруженных с помощью диффузионно-взвешенной визуализации, был выше, чем у T2-взвешенных изображений (86,4% против 62,9%) (P <0,001) [20].
Другая область, представляющая интерес - использование диффузионно-взвешенной визуализации в качестве альтернативы усиления гадолинием для обнаружения метастатических или первичных злокачественных новообразований печени. В последние годы специфические для печени контрастные агенты, такие как суперпарамагнитный оксид железа, который нацеливается на ретикулоэндотелиальную систему и поглощаются клетками Купфера, показали повышенный контраст между опухолью и печенью, в результате подавления сигнала в нормальной ткани печени. Недавнее исследование Nishie и соавт. [22] 30 пациентов с 50 узлами гепатоцеллюлярной карциномы показало, что использование МР-изображений с суперпарамагнитным оксидом железа, а также диффузионно-взвешенное изображение дает большую площадь по кривой ROC, чем использование (0,870 ± 0,04 против 0,820 ± 0,05 [P = 0,025]). Аналогично, исследование Koh et al [23] обнаружения колоректальных метастазов в печени показало, что добавление диффузионно-взвешенной визуализации к МР-визуализации с использованием специфического для печени контрастного агента мангафодипир-тринатрия дает значительно более высокую диагностическую точность (площадь под кривой ROC увеличилась до 0,96 и 0,94 соответственно для двух наблюдателей), чем когда один из методов используется один.
Другая роль диффузионно-взвешенной визуализации заключается в характеристике ткани, когда используются более высокие значения b (> 500 с / мм2) и ADC. После обнаружения поражения печени для дополнительной оценки морфологии поражения используется диффузионно-взвешенное исследование с высоким значением b-значения в сочетании с МР-томографией с контрастным усилением и картированием ADC (Рис 18-23) [6].
Ложноположительная идентификация поражения как злокачественного новообразования может возникать при эффекте Т2-просвечивания и высоко клеточном доброкачественном поражении, таком как аденома, очаговая узелковая гиперплазия или абсцесс. С другой стороны, ложноотрицательная характеристика опухоли может возникать в случаях некротических или кистозных опухолей, таких как муцинозная аденокарцинома или высоко дифференцированная гепатоцеллюлярная аденокарцинома [2].
Применение карт ADC в дифференцировке доброкачественных злокачественных образований в последние годы стало предметом многих исследований. В недавнем исследовании 382 пациентов Миллером и др. [24] средние значения ADC для доброкачественных и злокачественных поражений печени составляли 2,5 × 10-3 мм2 / сек и 1,52 × 10-3 мм2 / сек, соответственно. В то время как кисты и гемангиомы легко различимы с другими поражениями, значения ADC солидных доброкачественных и злокачественных поражений перекрываются. Высоко клеточные доброкачественные поражения, такие как фокальная узелковая гиперплазия и аденома, являются наиболее проблематичными, поскольку они имеют средние значения ADC, близкие к значениям злокачественных поражений, включая гепатоцеллюлярную карциному. В разных исследованиях были продемонстрированы различия в значениях отсечения ADC для разных субъектов болезни из-за значительнjq hfpybws в аппаратных средствах, методах взвешивания и величины b. В нашем учреждении карты ADC печени восстанавливаются из изображений, полученных при значениях b 0 и 750 с / мм2.
Оценка реакции опухоли после лечения с помощью биомаркеров визуализации имеет важное значение для оценки поведения опухоли, планирования будущих методов лечения и оценки рецидива опухоли. Изменения опухоли анализируются как качественно, так и количественно с помощью диффузионно-взвешенной визуализации. Качественный анализ основан на визуально оцениваемых изменениях интенсивности сигнала из-за ответа на лечение опухоли, например, увеличение сигнала ADC при поражениях, которые ответили на лечение или новые области аномальной интенсивности сигнала из-за прогрессирования заболевания. Пространственная оценка ответа на лечение опухоли может быть достигнута с использованием функциональных карт диффузии, созданных после регистрации карт ADC до и после лечения, что позволяет сравнивать изменения значений ADC на уровне воксела к вокселу [25]. Реакция на терапию часто проявляется как увеличение значений ADC относительно низкого значения ADC опухоли до лечения (Рис 24-27). Последующая диффузионно-взвешенная визуализация демонстрирует различное поведение интенсивности сигнала в зависимости от тканевого компонента и типа используемой терапии. После трансартериальной хемоэмболизации [26] или радиоэмболизации с мечеными иттрием-90-мечеными микросферами [27] значения ADC гепатоцеллюлярной карциномы могут проявляться в раннем снижении с последующим последовательным увеличением, которые напоминают кистозные или некротические изменения. Переходное снижение значений ADC также наблюдалось после начала терапии, в результате клеточного набухания, уменьшения кровотока или уменьшения объема внеклеточного пространства.
Наряду с контрастной МР-визуализацией, спектроскопией и эластографией, диффузионно-взвешенное изображение показало себя перспективным в оценке диффузного заболевания печени. Изображение диффузного заболевания печени основано на богатой коллагеном фиброзном перерождении нормальной ткани печени, что ограничивает свободную диффузию молекул воды, тем самым уменьшая значение ADC относительно нормальной ткани печени (Рис 28-30). В недавнем исследовании 78 пациентов с циррозом печени Sandrasegaran и др. [28] продемонстрировали, что значения ADC значительно ниже у пациентов с более высокой степенью фиброза, чем у пациентов с меньшим или отсутствием фиброза печени. Корреляция между значением ADC и степенью фиброза была продемонстрирована в нескольких исследованиях. Однако определение значения отсечки ADC для диагностики или прогнозирования фиброза печени и ее причины по-прежнему остается предметом обсуждения. Недавние исследования показали, что нормализованные значения ADC превосходят чистые значения ADC в диагностике фиброза печени. Do et al [29] рассмотрел возможность нормализации значений ADC печени для печени селезенки для оценки фиброза печени. Они пришли к выводу, что использование нормированного значения ADC является потенциально воспроизводимым методом с более высокой диагностической точностью при выявлении цирроза и фиброза [29].
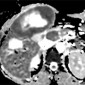
Исследование почек
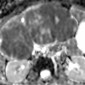
Точная характеристика образований почек необходима для обеспечения надлежащего стадирования и прогноза. Кроме того, различные подтипы почечно-клеточной карциномы (ПКК) по-разному реагируют на молекулярно-целевые методы лечения [30]. Паттерн увеличения интенсивности сигнала при диффузионно-взвешенном изображении и уменьшенных значениях ADC при ПКК аналогичен картине при солидных злокачественных поражениях других органов (Рис 31-33). Taouli et al [31] обнаружили значительно более низкие ADC в солидных ПКК, чем при кистах и онкоцитомах, а в другом исследовании были продемонстрированы более высокие значения ADC в ПКК, чем при карциноме переходных клеток (2,71 × 10-3 мм2 / сек против 1,61 × 10 -3 мм2 / с) [32]. Недавнее исследование показало чувствительную и специфическую дифференцировку между ячеистыми, папиллярными и хромофобными РКЦ и предложило использовать значения b 0 и 800 с / мм2 при 3,0 Тл и пороговое значение ADC 1,281-10,3 мм2 / с, Прозрачной ячейки ПКК, показывающей самый большой средний ADC (1,698 × 10-3 мм2 / сек) трех подтипов [33].
Исследование органов малого таза
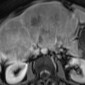
Мужской таз. Использование диффузионно-взвешенной визуализации для оценки органов таза у мужчин фокусируется на оценке предстательной железы. Все больше доказательств того, что диффузионно-взвешенное изображение улучшает чувствительность и специфичность при выявлении рака предстательной железы. Недавние исследования также показали, что диффузионно-взвешенная визуализацию, оказывает положительное влияние на стадирование, оценку агрессивности опухоли и ответной реакции на лечение. Также была продемонстрирована полезность диффузионно-взвешенной визуализации как биомаркера в отношении локального рецидива рака предстательной железы и оценки метастатазирования. Как и другие виды рака, рак предстательной железы имеет тенденцию к более высокой плотности клеток и избытку внутри- и межклеточных мембран по сравнению с нормальной железистой тканью [3]. Для интерпретации изображений МР простаты требуется просмотр изображений с диффузионно-взвешенным изображением и их сравнение с взвешенными по T2 изображениями и картами ADC.
Раковая ткань имеет более высокую интенсивность сигнала на диффузионно-взвешенных изображениях с высоким значением b, чем здоровая ткань простаты, и демонстрирует снижение значений ADC (Рис 34-35).
На исходных диффузионно-взвешенных изображениях рак предстательной железы обычно не заметен при значениях b менее 500 с / мм2. Для МРТ предстательной железы обычно использовались значения 0 и 800-1500 сек / мм2 в зависимости от параметров сканирования. Карты ADC особенно полезны из-за эффекта T2-просвечивания, наблюдаемой на диффузионно-взвешенных изображениях. Более низкие значения ADC рака предстательной железы коррелируют с более высокой клеточностью при гистологическом анализе. Sato и др. [34] сравнивали значения ADC нормальной и раковой ткани как в периферической, так и в переходной зонах при 1,5 Тл. В обеих зонах значения ADC рака простаты были значительно ниже, чем у доброкачественных тканей. Средние значения ADC, рассчитанные по данным диффузионно-взвешенной визуализации, полученным с однократной эхопланарной последовательностью при 1,5 Тл для нормальной периферической зоны, центральной части предстательной железы и рака предстательной железы, составили 1,992 × 10-3 мм2 / с ± 0,208, 1,518 × 10-3 мм2 / с ± 0,126 и 1,214 × 10-3 мм2 / с ± 0,254 соответственно [34].
Kim и др. [35] обследовали пациентов на 3,0 Тл с помощью фазированной решетки и однозарядной эхопланарной диффузионно-взвешенной последовательности при значениях b 0 и 1000 с / мм2. Они обнаружили, что значения ADC злокачественных тканей были значительно ниже, чем у доброкачественных тканей как в периферической зоне (1,32 × 10-3 мм2 / с ± 0,24 против 1,97 × 10-3 мм2 / с ± 0,25), так и в переходной зоне ( 1,37 × 10-3 мм2 / с ± 0,29 против 1,79 × 10-3 мм2 / с ± 0,19). Для диагностики опухоли использование значений отсечки 1,67 × 10-3 мм2 / сек для периферической зоны и 1,61 × 10-3 мм2 / сек для переходной зоны приводило к чувствительности 94% и 91% соответственно, а также к специфичности 90% и 84% соответственно [35].
Хотя исследования показали повышенную чувствительность и специфичность диффузионно-взвешенной визуализации при диагностике рака предстательной железы, опухоли размером менее 5 мм трудно обнаружить. Кроме того, воспаление может привести к снижению значений ADC. В переходной зоне дополнительная проблема возникает при доброкачественных гиперпластических узлах, которые могут иметь низкие значения ADC и тем самым имитировать опухоль. Однако, когда интерпретация Т2-взвешенного изображения используется в сочетании с картами ADC, улучшается обнаружение очагов опухолей в переходной зоне [36]. Постбиопсиальное кровоизлияние в предстательную железу может приводить к образованию фокусов с низкой интенсивностью сигнала на взвешенных по T2 изображениях и может имитировать опухоль на диффузионно-взвешенных изображениях, что приводит к ложноположительной интерпретации. Однако включение T1-взвешенных последовательностей в рутинном протоколе визуализации МРТ простаты позволяет выявлять кровоизлияние и прямую корреляцию с результатами T2- и диффузионно-взвешенной визуализации. Кровоизлияние может снизить значения ADC в доброкачественных тканях и уменьшить контраст между доброкачественными и злокачественными тканями. Кроме того, кровоизлияние может вызвать артефакты восприимчивости [37].
Опухолевые значения ADC могут помочь выявить пациентов с локализованным раком предстательной железы с низким уровнем риска, которые могут извлечь выгоду из радикального лечения.
Для стадирования рака предстательной железы диффузионно-взвешенное изображение может быть полезным при оценке вовлечения в процесс семенных пузырьков, демонстрируя низкие значения ADC в этом регионе (при отсутствии кровоизлияния на изображениях, взвешенных по T1), а также вовлечения лимфатических узлов, Поскольку злокачественные узлы имеют более низкие значения ADC [40]. Улучшение обнаружения метастатических узлов при помощи диффузионно-взвешенной визуализации может помочь в планировании лечения.
Было показано, что значения ADC являются многообещающим биомаркером для мониторинга пациентов, получавших лучевую терапию. В исследовании, проведенном Song et al [41], было показано, что среднее значение ADC опухоли увеличивается после лучевой терапии, тогда как средние значения ADC после терапии у пациентов с доброкачественной периферической и переходной зонами были ниже, чем их значения до терапии. У пациентов с биохимическим рецидивом после прохождения лучевой терапии использование диффузионно-взвешенной визуализации вместе с T2-взвешенной визуализацией показало большую чувствительность к обнаружению рецидива, чем только T2-взвешенное изображение [42]. У пациентов с метастатическим заболеванием костей увеличение значения ADC опухоли коррелировало с уменьшением уровней простато-специфических антигенов у лиц, которые лечилась антиандрогеновой терапией [43].
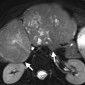
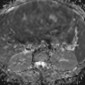
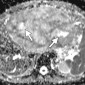
Женский таз. Добавление диффузионно-взвешенной визуализации к обычному протоколу МР-исследования позволяет оценивать онкологические образования в женском тазу, от обнаружения повреждений и характеризации до постановки злокачественных новообразований. Было показано, что МР-томография превосходит обычные методы визуализации и клиническое обследование для выявления рака шейки матки [44]. Рак шейки матки демонстрирует более низкие значения ADC (т.е. более ограниченную диффузию), чем нормальная ткань шейки матки (Рис 36-38). Naganawa и др. [45] изучили 12 пациентов с раком шейки матки и обнаружили, что значение ADC раковой ткани значительно ниже, чем у нормальной ткани шейки матки (1,09 × 10-3 мм2 / с ± 0,20 против 1,79 × 10-3 мм2 / сек ± 0,24) (P <0,0001). Однако значение отсечки ADC для дифференциации между раком и нормальной шейкой ткани и между различными типами рака широко варьировалось среди учреждений, что может быть связано с изменчивостью используемых аппаратных средств и методов анализа изображения. Диффузионно-взвешенная визуализация показала перспективность для стадирования рака шейки матки, позволив более точно определить глубину инвазии и статус узлового поражения (Рис 36-38) [46]. 3,0-Т МР-томографии у 50 пациентов Lin и др. [46] показали, что метастатически пораженные лимфатические узлы имеют значительно более низкие значения ADC, чем интактные лимфатические узлы (0,06 × 10-3 мм2 / с против 0,21 × 10-3 мм2 / Сек) (P <0,001). Авторы также обнаружили, что чувствительность комбинированного размера узла и значения ADC была выше, чем у обычной МР-томографии (83% против 25%) с одинаковой специфичностью (соответственно 98% и 99%) [46]. Роль диффузионно-взвешенной визуализации более противоречива в отличии рака яичников от доброкачественных поражений яичников. Существует дополнительное преимущество, когда диффузионно-взвешенное изображение сочетается с обычной МР-визуализацией для постановки рака яичников и перитонеальных метастазов. В исследовании 34 пациентов с раком яичников по Low и соавт. [47] комбинация диффузионно-взвешенной визуализации и обычной МР-томографии с контрастным усилением имела более высокую чувствительность и точность для обнаружения метастатических перитонеальных отсевов, чем только один из методов.
Перитонеальные отсевы демонстрируют ограниченную диффузию на диффузионно-взвешенные изображения и, следовательно, низкие значения ADC.
Наличие асцита может помочь улучшить разграничение и видимость повреждений отсевов [47]. Более того, добавление диффузионно-взвешенной визуализации к обычным методам МР-визуализации оказалось полезным для обнаружения и стадирования рака эндометрия, включая оценку глубины инвазии в качестве индикатора потенциального метастатического распространения злокачественных новообразований. В исследовании 48 пациентов с раком эндометрия Lin и др. [48] показали, что добавление диффузионно-взвешенной визуализации к Т-взвешенному и динамическому контрастированию повышает точность обнаружения поражения миометрия по сравнению с любым из этих методов по отдельности.
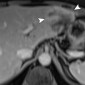
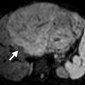
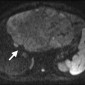
FIGO (Международная федерация гинекологии и акушерства) IIB-степень 3A карциномы шейки матки у 30-летней женщины. При клиническом обследовании было отмечено образование, вовлекающее верхнюю половину влагалища, при этом шейка матки была направлена вправо. Метастатическая аденопатия была обнаружена при 1,5-Т МР-томографии, выполненной с помощью катушки для тела.
Диффузионно-взвешенное исследование всего тела
В литературе есть несколько сообщений о возможности диффузионно-взвешенного исследования всего тела, при оценке больных раком [49]. Ясно, что, комбинируя анатомическую визуализацию (например, T1- и T2-взвешенную визуализацию) с полномасштабной диффузионно-взвешенной визуализацией, можно визуализировать ранние изменения в первичной опухоли и метастатазах, которые могут предоставить важную информацию о реакции на лечение и позволяют разработать индивидуальные режимы лечения. Таким образом, использование этих методов диффузионно-взвешенного исследования всего тела для выявления и классификации рака и мониторинга лечения является целями, которые в ближайшем будущем достижимы (Рис 39-41). В исследовании, проведенном при 1,5 Т, впервые была описана методика диффузионно-взвешенного исследования всего тела, известная как «диффузионно-взвешенное изображение всего тела с подавлением фонового сигнала». Takahara и др. [49] в этом исследовании используют свободный подход к дыханию во время визуализации, несколько тонких аксиальных секций и большое количество полученных сигналов. Кроме того, подавление жира применяется с помощью либо короткого инверсионного восстановления инверсии, либо какого-либо другого надежного метода. По существу, диффузионно-взвешенная визуализация с подавлением фонового сигнала использует как когерентное, так и некогерентное движение внутривоксельных движений, используя свободное дыхание во время визуализации, чтобы визуализировать представляющий интерес орган [50]. Следует отметить, что для точного подавления фона необходимы как большие значения b (> 500 с / мм2), так и большое количество полученных сигналов, что увеличивает время сбора.
Выводы:
Диффузионно-взвешенное изображение-ADC-картирование предоставляет информацию о функциональной среде воды в тканях, тем самым увеличивая морфологическую информацию, обеспечиваемую обычной МР-визуализацией. Обнаруженные изменения включают сдвиги воды от внеклеточного до внутриклеточного пространства, ограничение проницаемости клеточной мембраны, увеличение клеточной плотности и нарушение деполяризации клеточной мембраны. Эти данные обычно связаны со злокачественными новообразованиями; Поэтому диффузионно-взвешенное изображение имеет много применений в онкологическом изображении, предоставляя функциональную информацию, дополняющую изучение анатомического строения тела, предоставленную МР-визуализацией, и тем самым способствуя обнаружению и характеристике опухоли, а также в прогнозировании и оценке ответа на терапию.
Литература
- Koh DM, Collins DJ. Diffusion-weighted MRI in the body: applications and challenges in oncology. AJR. American journal of roentgenology. 188 (6): 1622-35. doi:10.2214/AJR.06.1403 - Pubmed
- Taouli B, Koh DM. Diffusion-weighted MR imaging of the liver. Radiology. 254 (1): 47-66. doi:10.1148/radiol.09090021 - Pubmed
- desouza NM, Reinsberg SA, Scurr ED, Brewster JM, Payne GS. Magnetic resonance imaging in prostate cancer: the value of apparent diffusion coefficients for identifying malignant nodules. The British journal of radiology. 80 (950): 90-5. doi:10.1259/bjr/24232319 - Pubmed
- Sinha S, Lucas-Quesada FA, Sinha U, DeBruhl N, Bassett LW. In vivo diffusion-weighted MRI of the breast: potential for lesion characterization. Journal of magnetic resonance imaging : JMRI. 15 (6): 693-704. doi:10.1002/jmri.10116 - Pubmed
- Kwee TC, Takahara T, Ochiai R, Katahira K, Van Cauteren M, Imai Y, Nievelstein RA, Luijten PR. Whole-body diffusion-weighted magnetic resonance imaging. European journal of radiology. 70 (3): 409-17. doi:10.1016/j.ejrad.2009.03.054 - Pubmed
- Qayyum A. Diffusion-weighted imaging in the abdomen and pelvis: concepts and applications. Radiographics : a review publication of the Radiological Society of North America, Inc. 29 (6): 1797-810. doi:10.1148/rg.296095521 - Pubmed
- Diffusion imaging concepts for clinicians. Journal of Magnetic Resonance Imaging. 27 (1): 1. doi:10.1002/jmri.21087
- Le Bihan D, Breton E, Lallemand D, Aubin ML, Vignaud J, Laval-Jeantet M. Separation of diffusion and perfusion in intravoxel incoherent motion MR imaging. Radiology. 168 (2): 497-505. doi:10.1148/radiology.168.2.3393671 - Pubmed
- Le Bihan D, Poupon C, Amadon A, Lethimonnier F. Artifacts and pitfalls in diffusion MRI. Journal of magnetic resonance imaging : JMRI. 24 (3): 478-88. doi:10.1002/jmri.20683 - Pubmed
- Wang CL, Chea YW, Boll DT, et al.. Effect of gadolinium chelate contrast agents on diffusion weighted MR imaging of the liver, spleen, pancreas and kidney at 3T. Eur J Radiol 2010 Jun 18.
- Partridge SC, Mullins CD, Kurland BF, Allain MD, DeMartini WB, Eby PR, Lehman CD. Apparent diffusion coefficient values for discriminating benign and malignant breast MRI lesions: effects of lesion type and size. AJR. American journal of roentgenology. 194 (6): 1664-73. doi:10.2214/AJR.09.3534 - Pubmed
- Pereira FP, Martins G, Carvalhaes de Oliveira Rde V. Diffusion magnetic resonance imaging of the breast. Magnetic resonance imaging clinics of North America. 19 (1): 95-110. doi:10.1016/j.mric.2010.09.001 - Pubmed
- Ei Khouli RH, Jacobs MA, Mezban SD, Huang P, Kamel IR, Macura KJ, Bluemke DA. Diffusion-weighted imaging improves the diagnostic accuracy of conventional 3.0-T breast MR imaging. Radiology. 256 (1): 64-73. doi:10.1148/radiol.10091367 - Pubmed
- Pereira FP, Martins G, Figueiredo E, Domingues MN, Domingues RC, da Fonseca LM, Gasparetto EL. Assessment of breast lesions with diffusion-weighted MRI: comparing the use of different b values. AJR. American journal of roentgenology. 193 (4): 1030-5. doi:10.2214/AJR.09.2522 - Pubmed
- Bogner W, Gruber S, Pinker K, Grabner G, Stadlbauer A, Weber M, Moser E, Helbich TH, Trattnig S. Diffusion-weighted MR for differentiation of breast lesions at 3.0 T: how does selection of diffusion protocols affect diagnosis?. Radiology. 253 (2): 341-51. doi:10.1148/radiol.2532081718 - Pubmed
- Costantini M, Belli P, Rinaldi P, Bufi E, Giardina G, Franceschini G, Petrone G, Bonomo L. Diffusion-weighted imaging in breast cancer: relationship between apparent diffusion coefficient and tumour aggressiveness. Clinical radiology. 65 (12): 1005-12. doi:10.1016/j.crad.2010.07.008 - Pubmed
- Partridge SC, McKinnon GC, Henry RG, Hylton NM. Menstrual cycle variation of apparent diffusion coefficients measured in the normal breast using MRI. Journal of magnetic resonance imaging : JMRI. 14 (4): 433-8. Pubmed
- Sharma U, Danishad KK, Seenu V, Jagannathan NR. Longitudinal study of the assessment by MRI and diffusion-weighted imaging of tumor response in patients with locally advanced breast cancer undergoing neoadjuvant chemotherapy. NMR in biomedicine. 22 (1): 104-13. doi:10.1002/nbm.1245 - Pubmed
- Park SH, Moon WK, Cho N, Song IC, Chang JM, Park IA, Han W, Noh DY. Diffusion-weighted MR imaging: pretreatment prediction of response to neoadjuvant chemotherapy in patients with breast cancer. Radiology. 257 (1): 56-63. doi:10.1148/radiol.10092021 - Pubmed
- Parikh T, Drew SJ, Lee VS, Wong S, Hecht EM, Babb JS, Taouli B. Focal liver lesion detection and characterization with diffusion-weighted MR imaging: comparison with standard breath-hold T2-weighted imaging. Radiology. 246 (3): 812-22. doi:10.1148/radiol.2463070432 - Pubmed
- Bruegel M, Gaa J, Waldt S, Woertler K, Holzapfel K, Kiefer B, Rummeny EJ. Diagnosis of hepatic metastasis: comparison of respiration-triggered diffusion-weighted echo-planar MRI and five t2-weighted turbo spin-echo sequences. AJR. American journal of roentgenology. 191 (5): 1421-9. doi:10.2214/AJR.07.3279 - Pubmed
- Nishie A, Tajima T, Ishigami K, Ushijima Y, Okamoto D, Hirakawa M, Nishihara Y, Taketomi A, Hatakenaka M, Irie H, Yoshimitsu K, Honda H. Detection of hepatocellular carcinoma (HCC) using super paramagnetic iron oxide (SPIO)-enhanced MRI: Added value of diffusion-weighted imaging (DWI). Journal of magnetic resonance imaging : JMRI. 31 (2): 373-82. doi:10.1002/jmri.22059 - Pubmed
- Koh DM, Brown G, Riddell AM, Scurr E, Collins DJ, Allen SD, Chau I, Cunningham D, deSouza NM, Leach MO, Husband JE. Detection of colorectal hepatic metastases using MnDPDP MR imaging and diffusion-weighted imaging (DWI) alone and in combination. European radiology. 18 (5): 903-10. doi:10.1007/s00330-007-0847-z - Pubmed
- Miller FH, Hammond N, Siddiqi AJ, Shroff S, Khatri G, Wang Y, Merrick LB, Nikolaidis P. Utility of diffusion-weighted MRI in distinguishing benign and malignant hepatic lesions. Journal of magnetic resonance imaging : JMRI. 32 (1): 138-47. doi:10.1002/jmri.22235 - Pubmed
- Padhani AR, Koh DM. Diffusion MR imaging for monitoring of treatment response. Magnetic resonance imaging clinics of North America. 19 (1): 181-209. doi:10.1016/j.mric.2010.10.004 - Pubmed
- Kamel IR, Bluemke DA, Eng J, Liapi E, Messersmith W, Reyes DK, Geschwind JF. The role of functional MR imaging in the assessment of tumor response after chemoembolization in patients with hepatocellular carcinoma. Journal of vascular and interventional radiology : JVIR. 17 (3): 505-12. doi:10.1097/01.RVI.0000200052.02183.92 - Pubmed
- Deng J, Miller FH, Rhee TK, Sato KT, Mulcahy MF, Kulik LM, Salem R, Omary RA, Larson AC. Diffusion-weighted MR imaging for determination of hepatocellular carcinoma response to yttrium-90 radioembolization. Journal of vascular and interventional radiology : JVIR. 17 (7): 1195-200. doi:10.1097/01.RVI.0000227234.81718.EB - Pubmed
- Sandrasegaran K, Akisik FM, Lin C, Tahir B, Rajan J, Saxena R, Aisen AM. Value of diffusion-weighted MRI for assessing liver fibrosis and cirrhosis. AJR. American journal of roentgenology. 193 (6): 1556-60. doi:10.2214/AJR.09.2436 - Pubmed
- Do RK, Chandarana H, Chandanara H, Felker E, Hajdu CH, Babb JS, Kim D, Taouli B. Diagnosis of liver fibrosis and cirrhosis with diffusion-weighted imaging: value of normalized apparent diffusion coefficient using the spleen as reference organ. AJR. American journal of roentgenology. 195 (3): 671-6. doi:10.2214/AJR.09.3448 - Pubmed
- Sun MR, Ngo L, Genega EM, Atkins MB, Finn ME, Rofsky NM, Pedrosa I. Renal cell carcinoma: dynamic contrast-enhanced MR imaging for differentiation of tumor subtypes--correlation with pathologic findings. Radiology. 250 (3): 793-802. doi:10.1148/radiol.2503080995 - Pubmed
- Taouli B, Thakur RK, Mannelli L, Babb JS, Kim S, Hecht EM, Lee VS, Israel GM. Renal lesions: characterization with diffusion-weighted imaging versus contrast-enhanced MR imaging. Radiology. 251 (2): 398-407. doi:10.1148/radiol.2512080880 - Pubmed
- Paudyal B, Paudyal P, Tsushima Y, Oriuchi N, Amanuma M, Miyazaki M, Taketomi-Takahashi A, Nakazato Y, Endo K. The role of the ADC value in the characterisation of renal carcinoma by diffusion-weighted MRI. The British journal of radiology. 83 (988): 336-43. doi:10.1259/bjr/74949757 - Pubmed
- Wang H, Cheng L, Zhang X, Wang D, Guo A, Gao Y, Ye H. Renal cell carcinoma: diffusion-weighted MR imaging for subtype differentiation at 3.0 T. Radiology. 257 (1): 135-43. doi:10.1148/radiol.10092396 - Pubmed
- Sato C, Naganawa S, Nakamura T, Kumada H, Miura S, Takizawa O, Ishigaki T. Differentiation of noncancerous tissue and cancer lesions by apparent diffusion coefficient values in transition and peripheral zones of the prostate. Journal of magnetic resonance imaging : JMRI. 21 (3): 258-62. doi:10.1002/jmri.20251 - Pubmed
- Kim CK, Park BK, Han JJ, Kang TW, Lee HM. Diffusion-weighted imaging of the prostate at 3 T for differentiation of malignant and benign tissue in transition and peripheral zones: preliminary results. Journal of computer assisted tomography. 31 (3): 449-54. doi:10.1097/01.rct.0000243456.00437.59 - Pubmed
- Yoshimitsu K, Kiyoshima K, Irie H, Tajima T, Asayama Y, Hirakawa M, Ishigami K, Naito S, Honda H. Usefulness of apparent diffusion coefficient map in diagnosing prostate carcinoma: correlation with stepwise histopathology. Journal of magnetic resonance imaging : JMRI. 27 (1): 132-9. doi:10.1002/jmri.21181 - Pubmed
- Park BK, Lee HM, Kim CK, Choi HY, Park JW. Lesion localization in patients with a previous negative transrectal ultrasound biopsy and persistently elevated prostate specific antigen level using diffusion-weighted imaging at three Tesla before rebiopsy. Investigative radiology. 43 (11): 789-93. doi:10.1097/RLI.0b013e318183725e - Pubmed
- van As NJ, de Souza NM, Riches SF, Morgan VA, Sohaib SA, Dearnaley DP, Parker CC. A study of diffusion-weighted magnetic resonance imaging in men with untreated localised prostate cancer on active surveillance. European urology. 56 (6): 981-7. doi:10.1016/j.eururo.2008.11.051 - Pubmed
- Park SY, Kim CK, Park BK, Lee HM, Lee KS. Prediction of biochemical recurrence following radical prostatectomy in men with prostate cancer by diffusion-weighted magnetic resonance imaging: initial results. European radiology. 21 (5): 1111-8. doi:10.1007/s00330-010-1999-9 - Pubmed
- Eiber M, Beer AJ, Holzapfel K, Tauber R, Ganter C, Weirich G, Krause BJ, Rummeny EJ, Gaa J. Preliminary results for characterization of pelvic lymph nodes in patients with prostate cancer by diffusion-weighted MR-imaging. Investigative radiology. 45 (1): 15-23. doi:10.1097/RLI.0b013e3181bbdc2f - Pubmed
- Song I, Kim CK, Park BK, Park W. Assessment of response to radiotherapy for prostate cancer: value of diffusion-weighted MRI at 3 T. AJR. American journal of roentgenology. 194 (6): W477-82. doi:10.2214/AJR.09.3557 - Pubmed
- Kim CK, Park BK, Lee HM. Prediction of locally recurrent prostate cancer after radiation therapy: incremental value of 3T diffusion-weighted MRI. Journal of magnetic resonance imaging : JMRI. 29 (2): 391-7. doi:10.1002/jmri.21645 - Pubmed
- Reischauer C, Froehlich JM, Koh DM, Graf N, Padevit C, John H, Binkert CA, Boesiger P, Gutzeit A. Bone metastases from prostate cancer: assessing treatment response by using diffusion-weighted imaging and functional diffusion maps--initial observations. Radiology. 257 (2): 523-31. doi:10.1148/radiol.10092469 - Pubmed
- Punwani S. Diffusion weighted imaging of female pelvic cancers: concepts and clinical applications. European journal of radiology. 78 (1): 21-9. doi:10.1016/j.ejrad.2010.07.028 - Pubmed
- Naganawa S, Sato C, Kumada H, Ishigaki T, Miura S, Takizawa O. Apparent diffusion coefficient in cervical cancer of the uterus: comparison with the normal uterine cervix. European radiology. 15 (1): 71-8. doi:10.1007/s00330-004-2529-4 - Pubmed
- Lin G, Ho KC, Wang JJ, Ng KK, Wai YY, Chen YT, Chang CJ, Ng SH, Lai CH, Yen TC. Detection of lymph node metastasis in cervical and uterine cancers by diffusion-weighted magnetic resonance imaging at 3T. Journal of magnetic resonance imaging : JMRI. 28 (1): 128-35. doi:10.1002/jmri.21412 - Pubmed
- Low RN, Sebrechts CP, Barone RM, Muller W. Diffusion-weighted MRI of peritoneal tumors: comparison with conventional MRI and surgical and histopathologic findings--a feasibility study. AJR. American journal of roentgenology. 193 (2): 461-70. doi:10.2214/AJR.08.1753 - Pubmed
- Lin G, Ng KK, Chang CJ, Wang JJ, Ho KC, Yen TC, Wu TI, Wang CC, Chen YR, Huang YT, Ng SH, Jung SM, Chang TC, Lai CH. Myometrial invasion in endometrial cancer: diagnostic accuracy of diffusion-weighted 3.0-T MR imaging--initial experience. Radiology. 250 (3): 784-92. doi:10.1148/radiol.2503080874 - Pubmed
- Takahara T, Imai Y, Yamashita T, Yasuda S, Nasu S, Van Cauteren M. Diffusion weighted whole body imaging with background body signal suppression (DWIBS): technical improvement using free breathing, STIR and high resolution 3D display. Radiation medicine. 22 (4): 275-82. Pubmed
- Le Bihan D, Breton E, Lallemand D, Grenier P, Cabanis E, Laval-Jeantet M. MR imaging of intravoxel incoherent motions: application to diffusion and perfusion in neurologic disorders. Radiology. 161 (2): 401-7. doi:10.1148/radiology.161.2.3763909 - Pubmed
- Malayeri AA, El Khouli RH, Zaheer A, Jacobs MA, Corona-Villalobos CP, Kamel IR, Macura KJ. Principles and applications of diffusion-weighted imaging in cancer detection, staging, and treatment follow-up. Radiographics : a review publication of the Radiological Society of North America, Inc. 31 (6): 1773-91. doi:10.1148/rg.316115515 - Pubmed