Опухоли орбиты у взрослых: клинический, радиологический и патологический обзор.
Опухоли орбит у взрослых могут быть подразделены по локализации и гистологическому типу. Данные визуализации этих поражений часто отражают их тканевую структуру. Кавернозные мальформации (также известные как кавернозные гемангиомы), хотя и не являются истинными опухолями, самые частые доброкачественные опухоли орбиты у взрослых. Они обычно выглядят как хорошо отграниченные, овоидные внутриконусные образования. Лимфомы первичные и вторичные наиболее частые новообразования у пожилых людей (старше 60 лет). Хороидальные меланомы самые частые первичные злокачественные опухоли глаза у взрослых. Меланин имеет парамагнитные свойства, приводящие к укорочению времени Т1 и Т2 релаксации, классически проявляющееся гиперинтенсивным сигналом на Т1 и гипоинтенсивным сигналом на Т2 ВИ. Однако меланомы с низким содержанием меланина могут выглядеть нетипично. Рак молочной железы чаще всего метастазирует в орбиту, за ним следует рак простаты, меланома, и рак легкого. У женщин с двусторонним энофтальмом необходимо исключать скиррозный рак молочной железы при дифференциальной диагностике. Опухоли из зрительного нерва и его оболочек включают глиомы и менингиомы. Глиомы часто вызывают веретенообразное расширение зрительного нерва, в котором сам нерв невозможно дифференцировать от опухоли. Напротив, классические менингиомы имеют вид «трамвайных рельсов», накапливающая контраст опухоль расположена вдоль вокруг зрительного нерва. Опухоли, исходящие из периферических нервов, включают шванномы и нейрофибромы. Последние связаны с нейрофиброматозом 1 типа. МРТ является особенно ценным для оценки новообразований орбиты, так как она обеспечивает важные анатомические сведения о вовлечении структур глаза, периневральном и интракраниальном распространении опухоли.
перевод статьи
Orbital Neoplasms in Adults: Clinical, Radiologic, and Pathologic Review 1
Tina D.Tailor, MD • Divakar Gupta, MD • RobertaW. Dalley, MD C. • Dirk Keene, MD, PhD Yoshimi Anzai, MD, MPH
RadioGraphics 2010; 30:461–482 • Published online 10.1148/rg.302095115
Введение
Орбитальные новообразования у взрослых составляют широкий спектр доброкачественных и злокачественных образований. Визуализация играет важную роль в характеристике этих поражений и их распространенности, дополняя клиническое офтальмологическое исследование, и обеспечивает информацией, помимо информации, полученной при осмотре глазного дна. Так же как и при всех заболеваниях орбиты, нужно учитывать вовлечение анатомических отделов. В дополнение при изучении известных или подозреваемых опухолей, внимание должно быть уделено тканям, из которых происходят опухоли. С этой точки зрения Shields и др. провели широкие исследования, изучив 1264 пациента, обратившихся в онкологическую службу с подозрением на опухоль орбиты или состояниями, симулирующими опухоль. В этой серии васкулогенные поражения были самыми частыми (17%), затем следовали лимфоидные поражения, поражения слезной железы, зрительного нерва и оболочек, метастатические, поражения периферических нервов и первичные меланомы. Хотя меланома самая частая первичная злокачественная опухоль глаза в этих сериях, она составляла 1% от всех поражений. Другие относительно редкие поражения включали фиброцитарные, миогенные, липогенные и миксоидные опухоли.
В этой статье обсуждаются клинические, гистопатологические и данные визуализации наиболее частых некостных орбитальных опухолей у взрослых.
Анатомические соображения
Знание анатомии орбиты важно для диагностики опухолей орбиты. Определение локализации не только помогает в дифференциальной диагностике, но точная локализация, вовлечение анатомических структур и протяженность диссеминации может помочь в планировании соответствующего лечения.
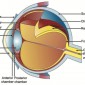
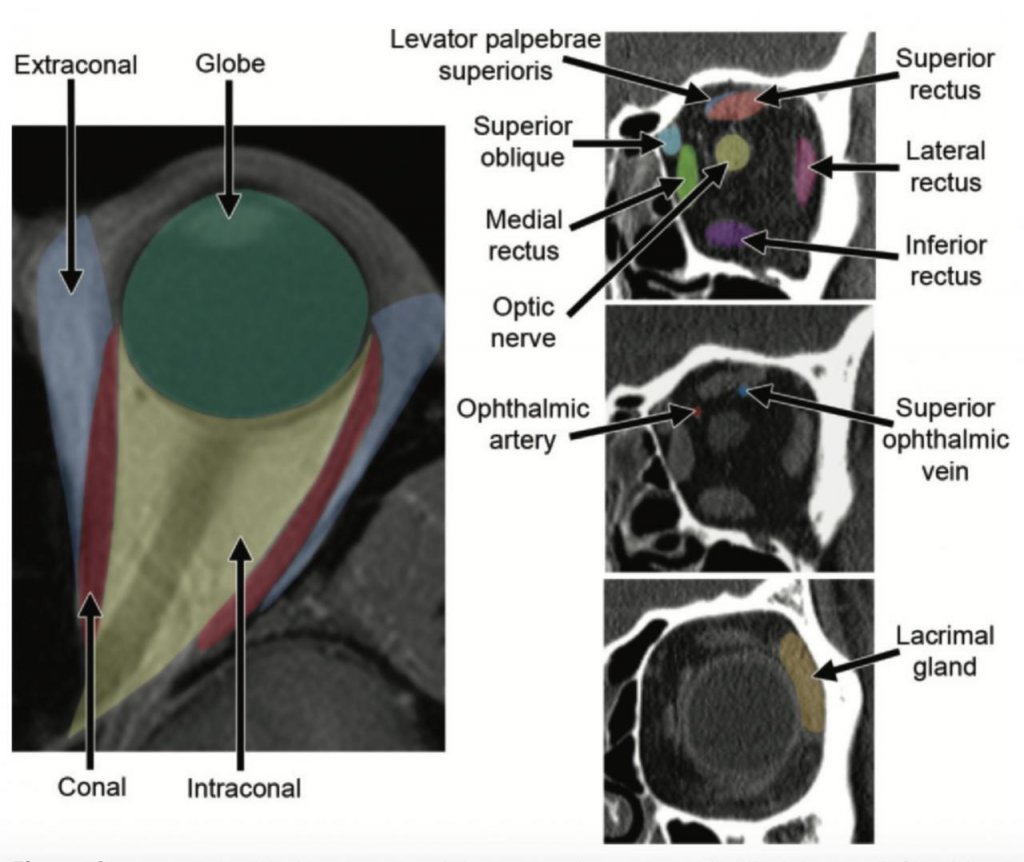
Орбита подразделяется на глазное яблоко, мышечный конус, внутриконусное и внеконусное пространства (Рис.1). Шесть экстраокулярных мышц обеспечивают движения глаза, все кроме нижней косой мышцы составляют мышечный конус. Мышечный конус суживается на верхушке орбиты, формируя сухожильное кольцо (кольцо Цинн). Через это кольцо проходят зрительный нерв, глазодвигательный нерв (верхняя и нижняя ветви), отводящий нерв, назоцилиарная ветвь глазничного нерва, и глазничная артерия. Мышечный конус разделяет внутриконусное и внеконусное пространства. Содержимое этих отделов в Таблице 1.
Глазное яблоко – продолжение центральной нервной системы, состоит из трех различных слоев (Рис.2). Наружный слой склера, затем сосудистая оболочка и сетчатка. Склера – коллагеновые ткани, которые кпереди продолжаются в роговицу, а кзади в твердую мозговую оболочку. Сосудистая оболочка или пигментированный сосудистый слой состоит из радужки, цилиарного тела и хороидеи. Хороидея самая васкуляризированная структура глаза и поэтому самое частое место внутриглазных метастазов. Сетчатка светочувствительная и продолжается кзади в зрительный нерв. Хотя оболочки глаза не дифференцируются при рутинных томографических исследованиях, они могут быть видны при отслойках (хороидеи, сетчатки).
Костная орбита должна быть изучена при рутинном исследовании мягкотканных образований орбиты. Наличие ремоделирования кости обычно предполагает медленно растущий процесс, тогда как костная эрозия более характерна для агрессивного поражения. Кроме того в костных отверстиях, а именно в канале зрительного нерва, верхней глазничной щели и в инфраорбитальном канале проходят нервы, вдоль которых может происходить периневральный рост и распространение в полость черепа (Рис.3, Таблица 2).
Васкулогенные орбитальные образования
Кавернозные мальформации
Кавернозные мальформации хотя и не истинные опухоли, но самые частые доброкачественные образования орбиты у взрослых. В литературе существует много разногласий об этиологии, классификации и номенклатуре этой патологии. Хотя эти образования часто называют кавернозные гемангиомы, многие патологи предпочитают термин кавернозная мальформация, так как старая терминология подразумевает васкулопролиферативное новообразование (2). Кавернозные мальформации считаются врожденными сосудистыми аномалиями, которые существуют при рождении, не подвергаются спонтанной инволюции и медленно растут. (3).
Пациенты с кавернозными мальформациями обычно взрослые средних лет (средний возраст 43-48 лет) с преобладанием женщин. Так как эти образования растут медленно, клинически они обычно проявляются прогрессивным безболезненным проптозом. Однако у некоторых пациентов наблюдается острый проптоз, вызванный цитокином и гормональной стимуляцией в подростковом возрасте или при беременности (3). Примерно у половины пациентов ограничение полей зрения, которые возникают из-за масс-эффекта на зрительный нерв или сосуды, его питающие (4). Хотя и редко, при вовлечении верхушки орбиты может развиться сдавление зрительного нерва и нейропатия, приводящая к монокулярной потере зрения. Другими менее частыми симптомами могут быть: боль, отек век, диплопия, и пальпируемое образование (3).
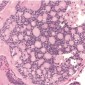
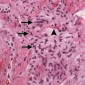
При микроскопии кавернозные мальформации выглядят как расширенные кавернозные пространства ограниченные плоскими эндотелиальными клетками и разделенными фиброзными септами (Рис.4). Фиброзная псевдокапсула окружает образование, придавая вид хорошо отграниченного узла при макроскопическом исследовании. Иногда может наблюдаться тромбоз и гиалинизация, но кальцификация бывает редко (4).
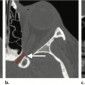
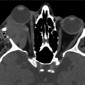
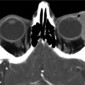
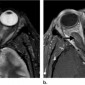
На КТ кавернозная мальформация обычно хорошо очерченная, гомогенная, овальной формы (Рис.5). Большинство кавернозных мальформаций возникает в латеральных отделах внутриконусного пространства (4). Конусные и внеконусные кавернозные мальформации встречаются редко. Флеболитов практически никогда не видно. Кавернозная мальформация смещает и окружает прилегающие структуры, такие как внеконусные мышцы и зрительный нерв, не вызывая прямой инвазии (5). Возможно ремоделирование кости, но деструкция кости бывает редко. (5). На МРТ на Т1 ВИ кавернозная мальформация изоинтенсивна мышцам, на Т2 ВИ гомогенно гиперинтенсивна без выпадений сигнала. На Т2 ВИ могут определяться внутренние перегородки (6). На мультифазной КТ (Рис.6a, 6b) накопление контраста в раннюю артериальную фазу слабое, из-за скудного артериального кровоснабжения (5). На отсроченной венозной фазе определяется прогрессивное контрастирование от периферии к центру с полным контрастированием в течение 30 минут (5,7).
Такой паттерн контрастирования может позволить дифференцировать кавернозную мальформацию от других сосудистых поражений с богатым артериальным кровоснабжением, таких как капиллярная гемангиома (педиатрический диагноз), гемангиоперицитома и артериовенозная мальформация (3).
Гемангиоперицитома
Гемангиоперицитома редкое новообразование, на которое приходится 1% всех опухолей орбиты (1). Пациенты обычно на пятом десятке жизни (средний возраст 41 год), преобладания какого-либо пола нет (8,9). Клинически обычно проявляется проптозом и пальпируемым образованием. Боль, диплопия, снижение зрения бывают реже (3,8). Гемангиоперицитома бывает от смешанной до явно злокачественной по гистологическому типу, растет медленно и может рецидивировать или метастазировать независимо от гистологического типа. Частота метастазирования 15%, чаще всего в легкие (8).
Гемангиоперицитомы развиваются из перицитов, клетки соединительной ткани вокруг мелких сосудов (9). Существуют споры о патогенезе и характеристике этих опухолей (10,11). Многие полагают, что термин гемангиоперицитома означает группу опухолей с одинаковым паттерном роста. Считается, что опухоли имеют такую же клеточную структуру, что и солитарные фиброзные опухоли, а некоторые патологи считают, что многие из этих опухолей лучше рассматривать как солитарные фиброзные опухоли (10,12).
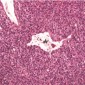
Гемангиоперицитома гистологически проявляется как плотная, высоко клеточная опухоль с веретенообразными клетками (Рис. 7).
Опухоли содержат неравномерно расширенные сосуды, васкулярный паттерн классически описывается как «оленьи рога». Анапластические признаки предполагают более агрессивную опухоль, содержащую увеличенные митозы, некроз, инфильтративные контуры и клеточные плеоморфизм (8).
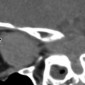
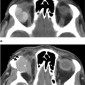
Типичные орбитальные гемангиоперицитомы внеконусные, обычно рядом с околоносовыми пазухами. Опухоли обычно дольчатые и хорошо отграниченные (Рис.8a). Агрессивные опухоли имеют инфильтративные контуры с возможными костными эрозиями (Рис.8b). Кальцинаты бывают редко. В отличие от кавернозной мальформации, гемангиоперицитома дает значительное артериальное усиление и контрастирование в раннюю венозную фазу с быстрым вымыванием при мультифазном КТ сканировании. Образование как правило изоинтенсивное серому веществу на Т1 ВИ и на Т2 ВИ - второй признак, который может помочь дифференцировать от кавернозной мальформации (3).
Лимфопролиферативные поражения
Лимфопролиферативные поражения самые частые первичные опухоли орбиты у пожилых (≥60 лет) (13). Эти поражения представляют собой ряд расстройств, включающие лимфоидную гиперплазию, атипичную лимфоидную гиперплазию и лимфому придатков глаза. Из них злокачественная лимфома самая частая и составляет 67%–90% орбитальных лимфопролиферативных опухолей и 24% всех орбитальных опухолей у пациентов старше 60 лет (14). Поражения могут проявляться системной лимфомой или первичной лимфомой орбиты, и более чем у 30% пациентов с солитарной лимфомой орбиты через 10 лет развивается системная лимфома (14). Неходжскинская лимфома, особый связанный со слизистой подтип лимфоидной ткани (MALT), самая частая первичная орбитальная лимфома (13,15).
Пациенты обычно представляются с пальпируемым образованием, проптозом и умеренным ограничением движений глаза (14). Боль нечастый симптом при лимфопролиферативных заболеваниях в отличие от орбитального псевдотумора, проявляющегося острой болью (14).
При микроскопии лимфопролиферативные заболевания могут быть доброкачественные (реактивная лимфоидная гиперплазия) или злокачественные (лимфома). Доброкачественные поражения проявляются хорошо дифференцированными, несколько плеоморфными лимфоцитами, тогда как злокачественные лимфомы (Рис.9) демонстрируют атипические клетки с патологией клеточных мембран (15, 16). Большинство орбитальных лимфом В-клеточного происхождения. Иммунологические маркеры особенно ценны для точной диагностики (16).
Рентгенологические исследования не позволяют уверенно дифференцировать доброкачественные и злокачественные лимфопролиферативные заболевания. Большинство поражений односторонние (76% случаев) и часто внеконусные. Слезная железа поражается примерно в 40% случаев (14). На КТ или МРТ около половины поражений диффузные и плохо отграниченные (Рис.10), другая половина выглядит как гладкие хорошо отграниченные образования. Характерно гомогенное контрастирование (14,16). Один из признаков этих опухолей тенденция к обрастанию орбитальных структур, таких как глазное яблоко (Рис.10a), зрительный нерв и стенки орбиты, опухоль распространяется вокруг последних, может вызвать ремоделирование костей. Деструкция костей достаточно редка, хотя иногда может возникать при диффузной крупноклеточной В-клеточной лимфоме (16). На МРТ большинство образований изоинтенсивно мышцам на Т1 ВИ и гиперинтенсивно по отношению к орбитальной жировой клетчатке на Т2 ВИ (17). Дифференцировать орбитальную лимфому и псевдотумор часто бывает сложно. Инфильтрация и утолщение глазных мышц говорит в пользу псевдотумора (16). В одном исследовании предполагается, что псевдотумор чаще изоинтенсивен жировой клетчатке орбиты на Т2 ВИ (17).
В ретроспективном исследовании 47 пациентов лимфому точно дифференцировали с псевдотумором на основании значений коэффициента диффузии (ADC) (18). Изучение клинических данных часто полезно, поскольку у пациентов с псевдотумором возникает относительно острый приступ боли, а при орбитальной лимфоме обычно болей не бывает. Однако, в конечном счете, для диагностики может быть необходима биопсия.
Образования слезной железы
Образования слезной железы составляют 5%-14% взятых на биопсию образований орбиты. Примерно половина из них доброкачественные, а вторая половина злокачественные (19). Образования слезной железы можно разделить на эпителиальные и неэпителиальные. Эпителиальные поражения составляют 40%–50% образований слезной железы и в большинстве опухоли (1,19). Неэпителиальные поражения преимущественно включают воспалительные (дакриоадениты) и опухолевые (лимфопролиферативные заболевания) процессы (20).
Эпителиальные поражения
Плеоморфная аденома. Плеоморфная аденома самая частая доброкачественная опухоль слезной железы, на которую приходится до 57% эпителиальных поражений (20). Называемая также доброкачественной смешанной опухолью, плеоморфная аденома содержит как мезенхимальные, так и эпителиальные элементы. Плеоморфные аденомы медленно растущие опухоли, которые обнаруживаются на 4-ой или 5-ой декаде жизни (21). Эти образования обычно смещают глазное яблоко книзу и вызывают проптоз. Боли бывают редко, а если есть, то наводят на мысль о другом, злокачественном типе поражения (19).
При гистологическом исследовании плеоморфная аденома имеет фиброзную псевдокапсулу с эпителиальными клетками. Клетки могут образовывать гнезда или трубочки, похожие на протоки (Рис.11a). В строме могут быть миксоидные веретенообразные клетки и муцин или могут быть гетерогенные элементы, такие как хрящевые или костные (15,21).
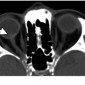
На КТ и МРТ плеоморфная аденома выглядит как хорошо отграниченное, обычно гомогенно накапливающее контраст образование в верхне-височной части орбиты. В больших опухолях может быть неоднородность за счет кистозной дегенерация, кровоизлияний, серозных или муцинозных скоплений или участков некроза (21). Из-за медленного роста опухоли может возникать ремоделирование кости, обычно выглядит как гладкая вогнутость в области слезной ямки (Рис.11b). Образование обычно гипоинтенсивное на Т1 ВИ и гиперинтенсивное на Т2 ВИ. Деструкция кости бывает редко и заставляет думать о злокачественности. Инфильтративные границы и узловатость также должны вызывать подозрение на злокачественность (20,21).
Когда клинический и визуализационный диагноз установлен, плеоморфная аденома иссекается блоком без биопсии. Неполное удаление или разрыв опухоли может привести к рецидиву или к злокачественной трансформации в плеоморфную аденокарциному. При удачном удалении опухоли прогноз отличный (22).
Аденоидная кистозная карцинома.
Аденоидная кистозная карцинома самая частая злокачественная опухоль слезной железы и вторая по частоте эпителиальная опухоль слезной железы и составляет примерно 5% от всех первичных опухолей орбиты (22). Большинство пациентов в 4-ой декаде жизни. Аденоидная кистозная карцинома инфильтративная с сильной склонностью к периневральному распространению. При таком распространении проптоз может быть минимальным, но пациента обычно беспокоят боли, являющиеся надежным клиническим признаком злокачественности (21). Полное хирургическое удаление может быть невозможным. Прогноз обычно плохой с 20% выживанием в последующие 10 лет (20).
При микроскопии опухоли не имеют капсулы и обычно состоят из эпителиальных клеток, образующих гнезда и хорды, таким образом, формируя характерный ситовидный паттерн (швейцарский сыр) (Рис.12). В отличие от плеоморфной аденомы аденоидная кистозная карцинома не имеет мезенхимального матрикса (15,21).
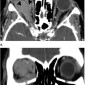
При визуализации в ранние сроки поражения аденоидной кистозной карциномой она может быть неотличима от плеоморфной аденомы. У пациентов в более поздние сроки могут определяется неровные контуры с деформацией глаза и содержимого орбиты (Рис.13).
Наличие костной деструкции предполагает злокачественность, кальцинаты также более характерны для карцином, чем для доброкачественных аденом (20,21). Черепно-мозговые нервы, особенно слезная ветвь глазничного нерва должны быть тщательно изучены для исключения периневральной инвазии (20).
Неэпителиальные поражения
Лимфопролиферативные заболевания составляют до 50% неэпителиальных поражений слезной железы (19). Злокачественная лимфома составляет подавляющее большинство этих лимфопролиферативных процессов. Тем не менее, лимфома слезной железы встречается довольно редко, составляет лишь 1% взятых на биопсию образований орбиты (1). Большинство лимфом слезной железы неходжкинские В-клеточные лимфомы (1,23).
Лимфома слезной железы заболевание пожилых людей, большинство из которых на 7 десятке жизни (средний возраст 62–69 лет) (1,23). Подобно плеоморфной аденоме заболевание классически проявляется безболезненным образованием в верхнелатеральном отделе орбиты. Лимфома слезной железы может быть ассоциирована с синдромом Шегрена. Примерно у 35% пациентов уже есть или в конечном итоге развиваются системные лимфомы (19). Прогноз обычно хороший с 70% 5-летней выживаемостью (23).
При микроскопии лимфома проявляется мелкими лимфоцитами, инфильтрирующими нормальную ткань слезной железы. Большинство лимфом слезной железы обладают низкой степенью гистологической характеристики (23).
На КТ обычно видно гомогенно накапливающее контраст образование в слезной ямке (Рис.14). Костной деструкции обычно нет, а если есть, то предполагает эпителиальное поражение. Вместо инфильтрации содержимого орбиты, лимфомы имеет тенденцию обрастать их и глазное яблоко (21,24). На МРТ характеристики сигнала от лимфомы неспецифические (7). Следует пытаться дифференцировать лимфому от плеоморфной аденомы, так как биопсии последней следует избегать из-за риска обсеменения. Пожилой возраст пациента, наличие лимфоаденопатии в другом месте и отсутствие ремоделирования кости являются признаками, наводящими на мысль о лимфоме (24). Низкие значения ADC также могут указывать на лимфому, в отличие от других заболеваний слезной железы (25). Другие, более редкие заболевания, которые могут имитировать опухоли, включают гранулематозные заболевания, такие как саркоидоз и гранулематоз Вегенера, которые часто имеют другие глазные симптомы, не определяемые при визуализации, например, увеит, кератит и конъюнктивит (26,27).
Поражения зрительного нерва и менингеальных оболочек
Глиома зрительного нерва
Глиома самая частая первичная опухоль зрительного нерва (1). Они могут возникать в любом месте зрительного тракта; 25%–48% расположены в орбите (7). Почти все глиомы зрительного нерва ювенильные пилоцитарные астроцитомы (grade 1 по классификации ВОЗ) и проявляются у детей младше 8 лет. Глиомы ассоциированы с нейрофиброматозом 1 типа (НФ-1). У 20% детей с НФ-1 есть глиома зрительного нерва, часто двусторонняя (7,28). Крайне редко у взрослых могут развиваться злокачественные глиомы зрительного нерва. Такие злокачественные глиомы агрессивны, не связаны с НФ-1, и классифицируются как анапластические астроцитомы или мультиформные глиобластомы.
Глиома зрительного нерва может быть бессимптомной и обнаруживаться случайно у пациентов с НФ-1, или может быть ограничение полей зрения, косоглазие со снижением зрения и относительный афферентный зрачковый дефект. Лечение, как правило, проводится в случаях с задокументированной прогрессией (28).
При гистологическом исследовании ювенильная пилоцитарная астроцитома состоит из веретенообразных астроцитов с волосовидными (пилоцитарными) отростками. Могут быть видны волокна Розенталя – эозинофильные дегенеративные клеточные процессы (Рис.15). Твердая мозговая оболочка остается интактной. Возможна лептоменингиальная реактивная гиперплазия и клеточная инфильтрация, что приводит к веретенообразному или колбасовидному утолщению нерва.
Злокачественная глиома зрительного нерва демонстрирует высокую митотическую активность, некрозы и кровоизлияния (15).
Визуализационные признаки глиомы зрительного нерва характерны, так что биопсия проводится редко (1) (Рис.16). МРТ метод выбора, в частности для оценки вовлечения верхушки орбиты, хиазмы, гипоталамуса и других интракраниальных структур (28). Опухоли обычно изоинтенсивны на Т1 ВИ и от изоинтенсивных до гиперинтенсивных на Т2 ВИ. Контрастирование вариабельное, могут быть видны кисты. Кальцинаты бывают редко (7). По периферии опухоли часто видно гиперинтенсивное на Т2 ВИ кольцо, признак имитирующий расширение субарахноидального пространства (Рис.16a). Однако этот признак соответствует лептоменингеальной инфильтрации и пролиферации (так называемый арахноидальный глиоматоз) (28).
Глиомы зрительного нерва выглядят по-разному при НФ-1 и без него. У пациентов с НФ-1 зрительный нерв часто выглядит извитым, с перегибами или изгибами и диффузно расширен (Рис.17). У пациентов без НФ-1 глиомы выглядят веретенообразными.
Изолированные глиомы хиазмы более вероятны без НФ-1, вовлечение хиазмы также чаще у пациентов без нейрофиброматоза (29). На изображениях сам зрительный нерв неотличим от опухоли - признак, помогающий дифференцировать глиому от менингиомы (7).
Смотрите также отдельную публикацию
Менингиома оболочек зрительного нерва
Глиомы оболочек зрительного нерва происходят из арахноидальной оболочки зрительного нерва. Менингиома вторая самая частая опухоль зрительного нерва, составляет 2% всех объемных образований орбиты (1). Первичные менингиомы зрительного нерва менее часты, чем вторичные, прорастающие в орбиту из полости черепа (15). Как и в случае с глиомой зрительного нерва, томографические изображения характерны, так что биопсия обычно не является оправданной (1). Так же как и интракраниальные менингиомы, менингиомы оболочек зрительного нерва чаще встречаются у женщин. Пациенты обычно на 5 десятке жизни (средний возраст 48–50 лет) (1,30). Классическая клиническая триада включает: безболезненную медленно прогрессирующую потерю зрения, атрофию зрительного нерва и оптикоцилиарные шунтирующие сосуды, которые появляются после длительной компрессии центральной вены сетчатки (30).
При гистологическом исследовании часто выявляется синцитиальный паттерн роста, состоящий из клеток без четких границ цитоплазмы. (Рис.18). Могут быть псаммоматозные тела (круглые кальцинаты, окруженные клетками менингиомы) (15,30).
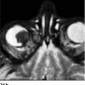
Подобно глиоме зрительного нерва менингиома оболочек зрительного нерва может выглядеть как расширение зрительного нерва. Однако, поскольку сам нерв не поражен, на аксиальных КТ или МРТ с контрастированием часто обнаруживается симптом «трамвайных рельсов», так как опухоль расположена по обе стороны нерва (Рис.19). На коронарных срезах конфигурация напоминает пончик (31). Помимо классической трубчатой формы, менингиома может выглядеть веретенообразным или эксцентричным образованием. МРТ с контрастированием метод выбора, особенно для определения распространенности заболевания (Рис.20).
Характеристики сигнала на Т1 и Т2 ВИ вариабельны (30). КТ лучше демонстрирует ремоделирование кости и кальцинаты, последние возникают в 20%–50% случаев (7,30).
Для всех опухолей зрительного нерва или оболочек зрительного нерва, включая глиомы и менингиомы, важно определить степень распространения заболевания и зафиксировать любые признаки прогрессирования опухоли. Клиницисты и хирурги должны точно знать, какую часть зрительного нерва и зрительного тракта (внутриорбитальную, интраканаликулярную или интракраниальную) поразила опухоль (Рис.20).
Опухоли зрительного нерва, включающие менингиомы у взрослых и глиомы у детей, обычно растут медленно, поэтому не требуют частого контроля. И наоборот менингиомы оболочек зрительного нерва у детей и глиомы зрительного нерва у взрослых могут быть агрессивными. Поэтому важно внимательно следить за степенью их распространения. Если опухоль распространяется к хиазме, может потребоваться хирургическое вмешательство для предотвращения распространения на противоположную сторону (32).
Поражения оболочек периферических нервов
Шваннома
Шваннома (называемая также неврилеммома или невринома) инкапсулированная медленно прогрессирующая доброкачественная пролиферация Шванновских клеток (33). Они формируются как эксцентричные новообразований (например, невриномы слухового нерва) любых периферических нервов, чаще всего из вестибулокохлеарного нерва. В орбитах шванномы редки, развиваются чаще всего из ветвей тройничного нерва, но могут расти из периферических ветвей глазодвигательного, трохлеарного и отводящего нерва, парасимпатических и симпатических волокон и цилиарного ганглия (1,6).
Шванномы, как правило, встречаются у людей среднего возраста; но могут быть в широком возрастном интервале (20–70 лет) (34). Клинические симптомы неспецифичны и могут быть похожими на симптомы кавернозной мальформации, затрудняя дооперационную офтальмологическую диагностику. Периневральное распространение может приводить к прогрессированию симптомов, боли и компрессии нервов. Таким образом, хирургическая резекция является методом выбора (6).
При микроскопии видны два различных паттерна (Рис.21). Antoni A паттерн - клеточный, состоит из веретенообразных клеток расположенных в виде пучков или хорд, которые могут формировать тела Verocay (вытянутые клетки расположенные в виде палисадника) (15). Antoni B паттерн - более свободное расположение звездчатых клеток в слизистой строме (33). Оба паттерна часто могут встречаться в одной опухоли.
Шваннома обычно внеконусное образование, расположенное в верхних отделах орбиты, часто происходящие из лобной ветви глазничного нерва, который делиться на супратрохлеарный и супраорбитальный нервы (34). Образования часто примыкают к отверстиям орбиты, приобретая коническую форму у вершины орбиты или форму гантели в области верхней глазничной щели (33).
МРТ превосходит КТ в диагностике шванном, оно облегчает предоперационное планирование, определяя точное расположение и степень распространения опухоли. Данные МРТ могут помочь дифференцировать шванному от кавернозной мальформации (6,33). Кроме того характеристики сигнала на Т2 ВИ и паттерн контрастирования могут предоставить гистопатологическую информацию (33). На Т1 ВИ шваннома обычно выглядит как гомогенно изоинтенсивное, хорошо очерченное образование, хотя такие признаки неспецифичны и могут варьировать. Шванномы обычно гиперинтенсивны на Т2 ВИ, но неоднородны, что отличает их от относительно однородного паттерна кавернозной мальформации (6) (Рис.22). Эта неоднородность вероятно отражает смешанную кистозно-солидную структуру опухоли, а также клеточный паттерн Antoni A и Antoni B. Шванномы с гистологическим типом Antoni В как правило гиперинтенсивны на Т2 ВИ, в то время как тип Antoni A имеет тенденцию к гипоинтенсивности на Т2 ВИ и накоплению контраста.(33). После внутривенного введения контраста обычно наблюдается неоднородное накопление контраста. (Рис.22b). Постепенное повышение контрастирования в отсроченную венозную фазу больше характерно для кавернозной мальформации, чем для шванномы (6,7).
Нейрофиброма
Нейрофибромы доброкачественные, медленно растущие опухоли периферических нервов, состояние из фибробластов, Шванновских клеток и аксонов (15). В орбите могут возникать локализованные, диффузные и плексиформные типы опухолей. Ампутационные (травматические) нейромы могут возникать у пациентов с оперативным вмешательством в анамнезе, таким как, например, энуклеация, хотя такие опухоли крайне редки (35).
Плексиформные нейрофибромы самый частый тип опухоли оболочек периферических нервов и по существу патогномоничны для НФ-1. Диффузный тип нейрофибромы менее связан с НФ-1. Солитарная нейрофиброма орбиты встречаются довольно редко (36). В одной серии из 1264 пациентов с опухолями орбиты только у двух (<1%) были обнаружены солитарные нейрофибромы (1). Солитарные формы связаны с нейрофиброматозом в около 12% случаев (36).
При гистологическом исследовании выявляются веретенообразные клетки, собранные в ленты и шнуры на фоне рыхлой миксоидной стромы. Большинство нейрофибром доброкачественные с отсутствием клеточной атипии. Солитарные подтипы хорошо отграничены, хотя в отличие от шванном у нейрофибром нет (15).
Подобно шванномам нейрофибромы обычно внеконусные, часто происходящие из чувствительных ветвей тройнпичного нерва (36) (Рис.23). На томографических изображениях плексиформные нейрофибромы определяются как змеевидные мягкотканные образования с неоднородным накоплением контраста. Они обычно гиперинтенсивны на Т2 ВИ и неоднородной интенсивности на Т1 ВИ. Эти поражения могут пересекать слои тканей и вовлекать большую часть лица. При клиническом и томографическом исследовании вид плексиформных нейрофибром часто сравнивают с мешком червей. Тенденция этих поражений проникать между слоями тканей также характерно для лимфатических мальформаций, но в последних определяются уровни жидкость/жидкость, лучше видимые на МРТ, признак очень характерный (37).
Клинические и визуалиционные признаки солитарной нейрофибромы неотличимы от признаков шванномы. Как и в случае с шванномами, одиночные нейрофибромы часто расположены в верхних отделах внеконусного пространства, вызывая смещение книзу глазного яблока (hypoglobus). Но поскольку у нее нет капсулы контуры солитарной нейрофибромы могут быть не так хорошо очерчены как у шванномы (7). Кистозный компонент и неоднородность на Т2 ВИ позволяет предположить шванному (36). Чаще всего различить эти две опухоли невозможно методами визуализации, что вероятно не критично, так как обе они легко поддаются хирургическому удалению. Основная причина попыток различать эти поражения то, что редко возникающая малигнизация, чаще бывает при нейрофиброме (38). Анамнез может быть особенно полезным в диагностике, поскольку нейрофиброма является признаком НФ-1, а шваннома более характерна для НФ-2 (39). При отсутствии такого анамнеза окончательный диагноз за патологоанатомом.
Злокачественные опухоли оболочек периферических нервов
Злокачественные опухоли оболочек периферических нервов могут развиваться первично или из предшествовавших опухолей. Они чаще всего поражают седалищный нерв и редки в краниофасциальной и орбитальной области (40). Образования – саркомы и часто при гистологическом исследовании происходят не из одной ткани. У больных с NF-1 пожизненный риск развития злокачественных опухолей оболочек периферических нервов 10%, которые чаще всего развиваются из плексиформных нейрофибром (39). Клинически и рентгенологически злокачественные опухоли могут быть неотличимы от доброкачественных. Сравнение с предыдущими исследованиями является ценным, быстрый рост и разрушение кости или мягких тканей заставляет думать о злокачественности (38,39).
Первичные меланоцитарные опухоли
Первичная меланома орбиты самая частая внутриглазная опухоль у взрослых. Она развивается значительно чаще у людей европеоидной расы (41). Другие факторы риска: светлая окраска радужки и окулярный меланоцитоз. Пациенты обычно на 6-ой декаде жизни (средний возраст 56 лет), преобладания какого-либо пола нет. В отличие от кожной меланомы, влияние на развитие увеальной меланомы ультрафиолетового облучения неясно (42).
Меланома орбиты развивается из увеального тракта, который состоит из хороидеи, цилиарного тела и радужки. Большинство опухолей (90%) происходит из хороидеи (41). Меланомы радужки относительно неагрессивны, тогда как при меланомах цилиарного тела и хороидеи прогноз гораздо хуже (43). Поскольку меланома радужки хорошо заметна, она обычно рано диагностируется и лечится хирургическим удалением без использования методов визуализации (42).
Напротив, примерно половина пациентов с меланомами хороидеи умирают от метастазов. Самое частое метастазирование в печень, оно бывает у 90% пациентов с метастатическим поражением (41). Кроме печени, поражаются легкие, кости и кожа (3). Лечение хороидальной меланомы зависит от размера опухоли, большие требуют энуклеации, а маленькие лечат органосохраняющими методами (44). Терапия метастатического поражения ограничена (41).
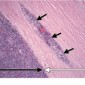
Хороидальная меланома может быть бессимптомной или может быть снижение зрения, дефекты полей зрения, или расплывчатость. Боль не типична (42). При росте образование расширяет хороидею и разрывают мембрану Бруха (самый внутренний слой хороидеи), образуя характерную форму гриба. Дальнейшее увеличение опухоли приводит к отслойке сетчатки в большинстве случаев (Рис.24a, 24b). Реже рост происходит криволинейно вдоль хороидеи (15). Клетки опухоли могут также инфильтрировать прилегающую склеру, приводя к эписклеральному распространению (Рис.24c).
Хороидальные меланомы состоят из веретенообразных клеток или эпителиодных клеток. В отличие от невусов, которые чаще содержат веретенообразные клетки A, меланомы хориоидеи содержат различное количество веретенообразных клеток B, которые имеют высокий ядерно-цитоплазматический коэффициент и более выраженные нуклеоли.
Эпителиоидные клетки имеют обильную цитоплазму, четкие контуры клеток и увеличенные овоидные ядра (15,41) (Рис.24c).
Диагноз обычно ставиться при осмотре глазного дна, но методы визуализации ценны для выявления распространенности заболевания (42). КТ не специфично, часто демонстрирует образование хороидеи повышенной плотности (Рис.25). МРТ превосходит КТ, так как меланин имеет свойства, приводящие к укорочению Т1 и Т2, проявляющиеся увеличением интенсивности сигнала на T1 и снижением интенсивности сигнала на Т2 ВИ (3,45) (Рис.26). Исследования показали, что степень меланоматозной пигментации коррелирует с интенсивностью Т1 сигнала (46). Эти данные могут быть ценными для прогноза, так как выраженная пигментация связана с неблагоприятным прогнозом. МРТ также значима для определения других признаков, таких как размеры опухоли, наличия экстраокулярного распространения и инфильтрации цилиарного тела, признаков, предвещающих плохой прогноз (46). Кроме того МРТ превосходит КТ для выявлении отслойки сетчатки и эписклерального распространения (45).
Примечательно, что около 20% меланом не содержат меланина, так что эффекты укорочения Т1 и Т2 при этом отсутствуют (46). Кроме того характеристики МР сигнала не всегда позволяют надежно отличить меланому от внутриглазного метастаза (47).
Метастатические поражения
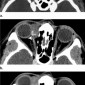
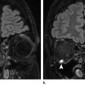
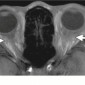
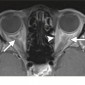
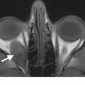
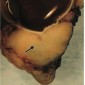
Метастазы других опухолей составляют 1% – 13% опухолей орбиты (1). Метастазы рака молочной железы самые частые метастазы в орбиту, составляют 48%–53% всех метастазов в орбиту, за ними следуют метастазы рака простаты, меланомы и рака легкого (48,49) (Рис.27–29). Метастазы в глазное яблоко чаще всего вовлекают хороидею, и чаще всего это метастазы рака легкого (50).
Клинические симптомы обычно появляются быстро, с прогрессированием в течение недель или месяцев (51). Среди самых частых симптомов проптоз и двигательные нарушения. Боль, диплопия и снижение зрения также бывают часто. Более редким симптомом, часто упускаемым из виду, является пародоксальный энофтальм, который наблюдается в 10% метастаических поражений орбиты (52). Пародоксальный энофтальм чаще всего является следствием метастазирования скиррозного рака молочной железы, который вызывает инфильтративные и фиброзные контрактуры орбитальной клетчатки, приводящие к заднему смещению глазного яблока (52,53). На МРТ, Т1 и Т2 ВИ в ретробульбарной клетчатке определяется диффузное усиление с патологической неоднородной гипоинтенсивностью, отражающей фиброзную инфильтрацию (Рис.28). В редких случаях этот паттерн также может наблюдаться при метастазах скирротической гастроинтестинальной карциномы (52).
Отличить метастаз в орбиту от неопухолевого инфильтративного процесса может быть проблематичным. Для конусных метастазов в частности дифференциальный диагноз включает тироидною офтальмопатию, которая часто бывает двусторонней и не вовлекает сухожилия мышц, а также орбитальный псевдотумор, который обычно болезненный и отличается от тироидной офтальмопатии вовлечением мышечных сухожилий. Гранулематозные заболевания, такие как саркоидоз, также могут имитировать метастатическое поражение и могут вовлекать экстраокулярные мышцы, зрительный нерв, хиазму и слезную железу (21,54).
При визуализации бывает трудно определить, в какой ткани возник метастаз, так как к моменту исследования он может инфильтрировать мышцы орбиты, клетчатку и кости. Однако различные опухоли имеют свои излюбленные локализации. Рак молочной железы метастазирует в жировую клетчатку и мышцы, рак простаты в кости, а меланома отдает сильное предпочтение мышцам (52). Знание этих предпочтений может быть полезным для рентгенолога в дифференциальной диагностике, а также помочь в случаях, когда первичная опухоль еще не выявлена.
Выводы
Томография может помочь в диагностике опухолей орбиты, дополняя данные исследования глазного дна и офтальмологического осмотра. Подход, основанный на локализации по отделам орбиты с учетом гистологических данных, помогает в дифференциальной диагностике в этой сложной группе заболеваний (Таблица 3). Использование МРТ особенно важно для оценки распространенности заболевания. Точное описание локализации, вовлечения определенных отделов орбиты, распространения на верхушку орбиты или периневрального роста, а также сопутствующей интракраниальной патологии обеспечивает дополнительной информацией помимо той, что можно увидеть на глазном дне, и облегчает выбор соответствующего лечения.
| Таблица 3. | ||
| Гистологический диагноз | Локализация | Характерные симптомы при визуализации |
| Сосудистые | ||
| Кавернозные мальформации | Чаще внутриконусные, чем внеконусные | Хорошо отграниченное овоидное образование, слабо накапливающее контраст в артериальную фазу и прогессивно контрастируещееся в отсроченную фазу |
| Гемангиоперицитома | Чаще внеконусные, чем внутриконусные | Опухоли низкой степени злокачественности, дольчатые, хорошо отграниченные. Признаки агрессивности: инфильтративные контуры, костные эрозии, значительное контрастирование в артериальную фазу и быстрое вымывание. |
| Лимфопролиферативные | ||
| Лимфоидная гиперплазия, атипичная гиперплазия, лимфома | Чаще внеконусные, чем внутриконусные | Доброкачественные и злокачественные образования не различимы. Образования могут быть гладкими хорошо очерченными или диффузными, плохо отграниченными. Контрастирование однородное. Образования стелятся по структурам орбиты, костные эрозии редки. |
| Слезная железа | ||
| Плеоморфная аденома | Внеконусная | Хорошо очерченное образование с однородным контрастированием. Часто ремоделирование кости. Костные эрозии подозрительны на другие, злокачественные опухоли. |
| Аденоидная кистозная карцинома | Внеконусная | На ранних стадиях выглядят как плеоморфные аденомы. Неровные края, смещение структур орбиты, возможны костные эрозии, тенденция к периневральному распространению. |
| Лимфома слезной железы | Внеконусная | Гомогенно накапливающее контраст округлое образование. Костные эрозии редки. |
| Зрительный нерв и его оболочки | ||
| Глиома зрительного нерва | Внутриконусное без или с внутричерепным распространением. | Веретенообразное расширение зрительного нерва. Извитость и перегибы зрительного нерва при НФ-1. |
| Менингиома оболочек зрительного нерва | Внутриконусное без или с внутричерепным распространением. | Накапливающая контраст опухоль в виде трамвайных рельсов на аксиальных КТ и МРТ. Возможно ремоделирование костей и кальцинаты. |
| Оболочки периферических нервов | ||
| Шваннома | Чаще внеконусные, чем внутриконусные. Часто в верхних отделах орбиты. | Смешанное кистозно-солидное образование с неоднородным контрастированием. Гантелевидное при распространении в верхнюю глазничную щель, конусовидное при распространении в вершину орбиты. |
| Нейрофиброма | Чаще внеконусные, чем внутриконусные. Может быть локальная, диффузная или плексиформная. | Плексиформный тип может вовлекать большие части лица в виде мешка с червями. Солитарный тип трудно отличить от шванномы. |
| Первичные меланоцитарные | ||
| Первичная меланома орбиты | Глаз. Чаще в хороидеи. | Накапливающее контраст образование хороидеи. Отслойка сетчатки. Возможен эписклеральный рост. |
| Метастатические | ||
| Самые частые: рак молочной железы, рак простаты, меланома и рак легкого. | Глаз, внутри конуса, вне конуса, в мышечном конусе. | Рак молочной железы чаще в жировой клетчатке и мышцах. Рак простаты в костях. Меланома строго предрасположена к поражению мышц. Скиррозный рак молочный железы вызывает энофтальм с неоднородным контрастированием ретробульбарной клетчатки. |
Литература
- Shields JA, Shields CL, Scartozzi R. Survey of 1264 patients with orbital tumors and simulating lesions: the 2002 Montgomery Lecture, part 1. Ophthalmology 2004; 111(5): 997–1008.
- Lowe LH, Marchant TC, Rivard DC, Scherbel AJ. Vascular malformations: classi cation and terminology the radiologist needs to know. Semin Roentgenol 2012; 47(2): 106–117.
- Smoker WR, Gentry LR,Yee NK, Reede DL, Nerad JA. Vascular lesions of the orbit: more than meets the eye. RadioGraphics 2008; 28(1): 185–204.
- Harris GJ, Jakobiec FA. Cavernous hemangioma of the orbit. J Neurosurg 1979; 51(2): 219–228.
- Ansari SA, Mafee MF. Orbital cavernous heman- gioma: role of imaging. Neuroimaging Clin N Am 2005; 15(1): 137–158.
- WangY, Xiao LH. Orbital schwannomas: ndings from magnetic resonance imaging in 62 cases. Eye (Lond) 2008; 22(8): 1034–1039.
- Yousem DM, Zimmerman RD, Grossman RI. Neuroradiology: the requisites. Mosby 2010;
- Croxatto JO, Font RL. Hemangiopericytoma of the orbit: a clinicopathologic study of 30 cases. Hum Pathol 1982; 13(3): 210–218.
- Ruchman MC, Flanagan J. Cavernous heman- giomas of the orbit. Ophthalmology 1983; 90(11): 1328–1336.
- Gengler C, Guillou L. Solitary brous tumour and haemangiopericytoma: evolution of a concept. Histopathology 2006; 48(1): 63–74.
- Park MS, Araujo DM. New insights into the hem- angiopericytoma/solitary brous tumor spectrum of tumors. Curr Opin Oncol 2009; 21(4): 327– 331.
- Goldsmith JD, van de Rijn M, Syed N. Orbital hemangiopericytoma and solitary brous tumor: a morphologic continuum. Int J Surg Pathol 2001; 9(4): 295–302.
- Demirci H, Shields CL, Shields JA, Honavar SG, Mercado GJ, Tovilla JC. Orbital tumors in the older adult population. Ophthalmology 2002; 109 (2): 243–248.
- Demirci H, Shields CL, Karatza EC, Shields JA. Orbital lymphoproliferative tumors: analysis of clinical features and systemic involvement in 160 cases. Ophthalmology 2008; 115(9): 1626–1631.
- Rosa RH, Buggage R, Harocopos GJ, et al. Ophthalmic pathology and intraocular tumors. San Francisco, Calif: American Academy of Ophthalmology 2011;
- Valvassori GE, Sabnis SS, Mafee RF, Brown MS, Putterman A. Imaging of orbital lymphoprolifera- tive disorders. Radiol Clin North Am 1999; 37(1): 135–150.
- Cytryn AS, Putterman AM, Schneck GL, Beck- man E, Valvassori GE. Predictability of magnetic resonance imaging in differentiation of orbital lymphoma from orbital in ammatory syndrome. Ophthal Plast Reconstr Surg 1997; 13(2): 129–134.
- Sepahdari AR, Aakalu VK, Setabutr P, Shiehm- orteza M, Naheedy JH, Mafee MF. Indeterminate orbital masses: restricted diffusion at MR imaging with echo-planar diffusion-weighted imaging pre- dicts malignancy. Radiology 2010;256(2):554–564
- Shields CL, Shields JA. Lacrimal gland tumors. Int Ophthalmol Clin 1993;33(3):181–188
- Jung WS, Ahn KJ, Park MR, et al. The radiological spectrum of orbital pathologies that involve the lac- rimal gland and the lacrimal fossa. Korean J Radiol 2007;8(4):336–342
- Mafee MF, Edward DP, Koeller KK, Dorodi S. Lacrimal gland tumors and simulating lesions: clinicopathologic and MR imaging features. Radiol Clin North Am 1999;37(1):219–239
- Bernardini FP, Devoto MH, Croxatto JO. Epithe- lial tumors of the lacrimal gland: an update. Curr Opin Ophthalmol 2008;19(5):409–413
- Rasmussen P, Ralfkiaer E, Prause JU, Sjö LD, Siersma VD, Heegaard S. Malignant lymphoma of the lacrimal gland: a nation-based study. Arch Ophthalmol 2011;129(10):1275–1280
- Lloyd GA. Lacrimal gland tumours: the role of CT and conventional radiology. Br J Radiol 1981;54 (648):1034–1038
- Politi LS, Forghani R, Godi C, et al. Ocular ad- nexal lymphoma: diffusion-weighted MR imaging for differential diagnosis and therapeutic monitor- ing. Radiology 2010;256(2):565–574
- Boukes RJ, de Vries-Knoppert WA. Lacrimal gland enlargement as one of the ocular manifestations of Wegener’s granulomatosis. Doc Ophthalmol 1985; 59(1):21–26
- Raskin EM, McCormick SA, Maher EA, Della Rocca RC. Granulomatous idiopathic orbital in- ammation. Ophthal Plast Reconstr Surg 1995;11 (2):131–135
- Avery RA, Fisher MJ, Liu GT. Optic pathway glio- mas. J Neuroophthalmol 2011;31(3):269–278
- Kornreich L, Blaser S, Schwarz M, et al. Optic pathway glioma: correlation of imaging ndings with the presence of neuro bromatosis. AJNR Am J Neuroradiol 2001;22(10):1963–1969
- Mafee MF, Goodwin J, Dorodi S. Optic nerve sheath meningiomas: role of MR imaging. Radiol Clin North Am 1999;37(1):37–58
- Kanamalla US.The optic nerve tram-track sign. Radiology 2003;227(3):718–719
- Miller NR. Primary tumours of the optic nerve and its sheath. Eye (Lond) 2004;18(11):1026–1037
- Garg R, Dhawan A, Gupta N, D’souza P. A rare case of benign isolated schwannoma in the inferior orbit. Indian J Ophthalmol 2008;56(6):514–515
- Xian J, Zhang Z, Wang Z, et al. Evaluation of MR imaging ndings differentiating cavernous haeman- giomas from schwannomas in the orbit. Eur Radiol 2010;20(9):2221–2228
- Messmer EP, Camara J, Boniuk M, Font RL. Am- putation neuroma of the orbit: report of two cases and review of the literature. Ophthalmology 1984; 91(11):1420–1423
- De Potter P, Shields CL, Shields JA, Rao VM, Eagle RC Jr, Trachtenberg WM. The CT and MRI features of an unusual case of isolated orbital neuro broma. Ophthal Plast Reconstr Surg 1992; 8(3):221–227
- Graeb DA, Rootman J, Robertson WD, Lapointe JS, Nugent RA, Hay EJ. Orbital lymphangiomas: clinical, radiologic, and pathologic characteristics. Radiology 1990;175(2):417–421
- Carroll GS, Haik BG, Fleming JC, Weiss RA, Mafee MF. Peripheral nerve tumors of the orbit. Radiol Clin North Am 1999;37(1):195–202
- Theos A, Korf BR; American College of Physi- cians; American Physiological Society. Pathophysiology of neuro bromatosis type 1. Ann Intern Med 2006;144(11):842–849
- Aydin MD,Yildirim U, Gundogdu C, Dursun O, Uysal HH, Ozdikici M. Malignant peripheral nerve sheath tumor of the orbit: case report and literature review. Skull Base 2004;14(2):109–113; discussion 113–114
- Spagnolo F, Caltabiano G, Queirolo P. Uveal mela- noma. Cancer Treat Rev 2012;38(5):549–553
- Grin JM, Grant-Kels JM, Grin CM, Berke A, Kels BD. Ocular melanomas and melanocytic lesions of the eye. J Am Acad Dermatol 1998;38(5 Pt 1): 716–730
- Shields CL, Shields JA, Materin M, Gershenbaum E, Singh AD, Smith A. Iris melanoma: risk factors for metastasis in 169 consecutive patients. Oph- thalmology 2001;108(1):172–178
- The Collaborative Ocular Melanoma Study (COMS) randomized trial of pre-enucleation radia- tion of large choroidal melanoma I: characteristics of patients enrolled and not enrolled. COMS report no. 9. Am J Ophthalmol 1998;125(6):767–778
- Mafee MF. Uveal melanoma, choroidal heman- gioma, and simulating lesions: role of MR imaging. Radiol Clin North Am 1998;36(6):1083–1099
- Lemke AJ, Hosten N, Bornfeld N, et al. Uveal mela- noma: correlation of histopathologic and radiologic ndings by using thin-section MR imaging with a surface coil. Radiology 1999;210(3):775–783
- De Potter P, Shields JA, Shields CL,Yannuzzi LA, Fisher YE, Rao VM. Unusual MRI ndings in met- astatic carcinoma to the choroid and optic nerve: a case report. Int Ophthalmol 1992;16(1):39–44
- Freedman MI, Folk JC. Metastatic tumors to the eye and orbit: patient survival and clinical character- istics. Arch Ophthalmol 1987;105(9):1215–1219
- Shields JA, Shields CL, Brotman HK, Carvalho C, Perez N, Eagle RC Jr. Cancer metastatic to the orbit: the 2000 Robert M. Curts Lecture. Ophthal Plast Reconstr Surg 2001;17(5):346–354
- Shields CL, Shields JA, Gross NE, Schwartz GP, Lally SE. Survey of 520 eyes with uveal metastases. Ophthalmology 1997;104(8):1265–1276
- Ahmad SM, Esmaeli B. Metastatic tumors of the orbit and ocular adnexa. Curr Opin Ophthalmol 2007; 18(5):405–413
- Goldberg RA, Rootman J, Cline RA. Tumors meta- static to the orbit: a changing picture. Surv Oph- thalmol 1990;35(1):1–24
- Meltzer DE, Chang AH, Shatzkes DR. Case 152: orbital metastatic disease from breast carcinoma. Radiology 2009;253(3):893–896
- Koyama T, Ueda H, Togashi K, Umeoka S, Kata- oka M, Nagai S. Radiologic manifestations of sar- coidosis in various organs. RadioGraphics 2004;24 (1):87–104