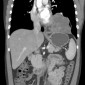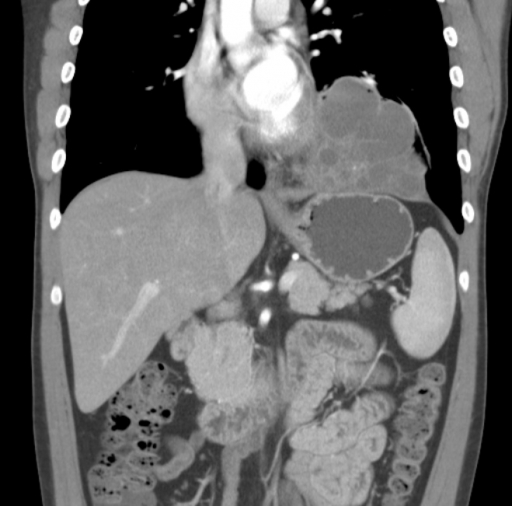
Секвестрация легкого, так называемое добавочное легкое, представляет собой порок развития, характеризующийся тем, что часть аберрантной легочной ткани не имеет связи с бронхиальным деревом и кровоснабжается артериями большого круга кровообращения отходящими от аорты.
Выделяются два типа:
Эпидемиология
Некоторые авторы предполагают наличие предрасположенности у мужского пола (когда речь идет о внедолевой легочной секвестрации). Возраст зависит от типа секвестрации.
Клиническая картина
Внедолевая секвестрация часто выявляется еще в периоде новорожденности за счет сопутствующего респираторного дистресс синдрома, цианоза или инфекции дыхательных путей. Внутридолевая секвестраця проявляется в позднем детском или подростковом периодах в виде рецидивирующих легочных инфекций.
Патология
Легочную секвестрацию можно разделить на две группы основываясь на отношении аберрантного сегмента легочной ткани к плевре:
- внутридолевая секвестрация
- встречается чаще и составлет 75-85% всех случаев [4,5,7]
- встречается в детском возрасте или подростковом периоде в виде рецидивирующих инфекций
- внедолевая секвестрация
- менее частая, составляет 15-25% всех случаев [4,5,7]
- обычно проявляется в период новорожденности в виде респираторного дистресс синдрома, цианоза и инфекций
- чаще встречается у мальчиков (М:Ж ~4:1)
- примерно в ~10% случаев бывает поддиафрагмальной
Оба типа схожи в отсутствии связи с бронхиальным деревом и легочными артериями, но имеют отличие в локализации по отношению к плевре. В большинстве случаев аберрантная легочная ткань кровоснабжается ветвью аорты. Венозный отток зависти от типа:
- внутридолевая секвестрация
- венозный отток обычно осуществляется в легочные вены, но иногда возможен отток в систему парной-непарной вен, воротную вену, правое предсердие или нижнюю полую вену
- аномальная ткань прилегает к нормальной легочной ткани и не отделена от нее плеврой
- внедолевая секвестрация
- венозный отток осуществляется через системные вены в правое предсердие
- отделена от окружающей легочной ткани собственной плеврой
Генетика
Почти все случаи спорадические.
Локализация
Легочная секвестрация преимущественно встречается в нижних долях. 60% внутридолевых секвестраций встречается в левой нижней доле и 40% в правой нижней доле. Внедолевая секвестрация почти всегда встречается в левой нижней доле, однако в 10% случаев внедолевая секвестрация может локализоваться поддиафрагмально [8].
Сочетанная патология
Сочетанная патология чаще сопутствует внедолевой секвестрации (50-60%):
- врожденная кистозноаденоматозная мальформация легкого
- врожденные пороки сердца
- врожденные диафргагмальные грыжи
- синдром ятагана [15]
Диагностика
Рентгенография
- часто проявляется в виде участка снижения пневматизации треугольной формы
- при присоединении инфекции возможно формирование кистозных просветлений
- при обоих типах наличие воздушной бронхограммы может указывать на связь с бронхиальным деревом (сформированную в результате инфекционной деструкции) или с пищеводом или желудком, как части комбинированного порока
УЗИ
Секвестрированная ткань обычно имеет более эхогенна по отношению к здоровой легочной ткани. При антенатальном УЗИ внедолевая секвестрация визуализируется с 16 недель в виде солидного, хорошо отграниченного эхогенного образования треугольной формы [8]. ЦДК может визуализировать афферентный сосуд. При поддиафрагмальной локализации секвестрация может визуализироваться в виде эхогенного образования брюшной полости.
Компьютерная томография
- мультипланарная реконструкция полезна для визуализации кровоснабжения из нисходящей аорты
- секвестрация обычно не содержит воздуха или газа (если нет присоединения инфекции)
- 3D реконструкции полезны для выявления [7]
- аномальных артерий
- аномальных вен
- дифференциации внути- и внедолевой секвестрации
Магнитно-резонансная томография
- T1: секвестрированный сегмент как правило имеет повышенный МР сигнал по отношению к здоровой легочной ткани [14]
- T2: секвестрированный сегмент как правило имеет повышенный МР сигнал по отношению к здоровой легочной ткани [14]
- МР ангиография: может быть полезна для визуализации аномального кровоснабжения
Дифференциальный диагноз
- абсцесс легкого
- врожденная кистозноаденоматозная мальформация легкого
- бронхогенная киста
- легочная артерио-венозная мальформация
- синдром ятагана
- малые размеры легкого с ипсилатеральным смещением средостения
- тень аномальной нисходящей вены в виде “турецкой сабли”, которая идет параллельно границе сердца
- правые границы сердца могут быть нечеткими, что ошибочно может быть принято тень секвестрации
Литература
- Blickman JG, Parker BR, Barnes PD. Pediatric radiology, the requisites. Mosby Inc. (2009) ISBN:0323031250.
- Berrocal T, Madrid C, Novo S, Gutiérrez J, Arjonilla A, Gómez-León N. Congenital anomalies of the tracheobronchial tree, lung, and mediastinum: embryology, radiology, and pathology. Radiographics : a review publication of the Radiological Society of North America, Inc. 24 (1): e17. doi:10.1148/rg.e17 - Pubmed
- Ferretti GR, Jouvan FB, Coulomb M. MDCT demonstration of intralobar pulmonary sequestration of the right upper lobe in an adult. AJR. American journal of roentgenology. 185 (6): 1663-4. doi:10.2214/AJR.05.0155 - Pubmed
- Tokel K, Boyvat F, Varan B. Coil embolization of pulmonary sequestration in two infants: a safe alternative to surgery. AJR. American journal of roentgenology. 175 (4): 993-5. doi:10.2214/ajr.175.4.1750993 - Pubmed
- Dhingsa R, Coakley FV, Albanese CT, Filly RA, Goldstein R. Prenatal sonography and MR imaging of pulmonary sequestration. AJR. American journal of roentgenology. 180 (2): 433-7. doi:10.2214/ajr.180.2.1800433 - Pubmed
- Franco J, Aliaga R, Domingo ML, Plaza P. Diagnosis of pulmonary sequestration by spiral CT angiography. Thorax. 53 (12): 1089-92; discussion 1088-9. Pubmed
- Lee EY, Boiselle PM, Cleveland RH. Multidetector CT evaluation of congenital lung anomalies. Radiology. 247 (3): 632-48. doi:10.1148/radiol.2473062124 - Pubmed
- Dhingsa R, Coakley FV, Albanese CT, Filly RA, Goldstein R. Prenatal sonography and MR imaging of pulmonary sequestration. AJR. American journal of roentgenology. 180 (2): 433-7. doi:10.2214/ajr.180.2.1800433 - Pubmed
- Ko SF, Ng SH, Lee TY, Wan YL, Liang CD, Lin JW, Chen WJ, Hsieh MJ. Noninvasive imaging of bronchopulmonary sequestration. AJR. American journal of roentgenology. 175 (4): 1005-12. doi:10.2214/ajr.175.4.1751005 - Pubmed
- García-Peña P, Lucaya J, Hendry GM, McAndrew PT, Duran C. Spontaneous involution of pulmonary sequestration in children: a report of two cases and review of the literature. Pediatric radiology. 28 (4): 266-70. doi:10.1007/s002470050348 - Pubmed
- West MS, Donaldson JS, Shkolnik A. Pulmonary sequestration. Diagnosis by ultrasound. Journal of ultrasound in medicine : official journal of the American Institute of Ultrasound in Medicine. 8 (3): 125-9. Pubmed
- Pessar ML, Soulen RL, Kan JS, Kadir S, Zerhouni EA. MRI demonstration of pulmonary sequestration. Pediatric radiology. 18 (3): 229-31. Pubmed
- Oliphant L, McFadden RG, Carr TJ, Mackenzie DA. Magnetic resonance imaging to diagnose intralobar pulmonary sequestration. Chest. 91 (4): 500-2. Pubmed
- Au VW, Chan JK, Chan FL. Pulmonary sequestration diagnosed by contrast enhanced three-dimensional MR angiography. The British journal of radiology. 72 (859): 709-11. doi:10.1259/bjr.72.859.10624331 - Pubmed
- Vida VL, Padalino MA, Boccuzzo G, Tarja E, Berggren H, Carrel T, Ciçek S, Crupi G, Di Carlo D, Di Donato R, Fragata J, Hazekamp M, Hraska V, Maruszewski B, Metras D, Pozzi M, Pretre R, Rubay J, Sairanen H, Sarris G, Schreiber C, Meyns B, Tlaskal T, Urban A, Thiene G, Stellin G. Scimitar syndrome: a European Congenital Heart Surgeons Association (ECHSA) multicentric study. Circulation. 122 (12): 1159-66. doi:10.1161/CIRCULATIONAHA.109.926204 - Pubmed
- Rishi Agrawal et al. Pulmonary sequestration. Radiographia.org