Аннотация:
Ожидаемые изменения на КТ или МРТ после лечения рака головы и шеи известны; важно не путать такие ожидаемые изменения с сохраняющейся или рецидивной опухолью, или осложнением лечения. Последующая обработка КТ или МРТ представляет определенную ценность при подозрении на рецидив опухоли, чтобы подтвердить наличие такого поражения и определить его степень. Это важная информация для определения возможности терапии. Реже изображения могут быть использованы в дифференцировке между рецидивом опухоли и осложнением лечения. У больных с высоким риском рецидива опухоли после лечения, визуализация представляет ценность для наблюдения за пациентом, в качестве дополнения к клиническому наблюдению. Базовое исследование должно быть выполнено в сроки приблизительно от 3 до 6 месяцев после окончания терапии. Доказано, что рецидивы опухоли можно обнаружить ранее систематического применения последующих мер визуализации.
Ключевые слова:
рецидив опухоли; лечение осложнений; некроз гортани; остеорадионекроз; хондрорадионекроз; свищ.
Введение:
После лечения рака головы и шеи определенные изменения тканей становятся видимыми на КТ и МРТ шеи. Эти ожидаемые изменения должны быть известны радиологу, чтоб не быть неверно истолкованными как оставшаяся ткань опухоли или её рецидив.
Визуализация может быть использована для мониторинга ответа опухоли на лечение, а также для обнаружения рецидива или оставшейся опухоли до их клинических проявлений, что дает больше шансов для успешного спасения. Осложнения лечения, такие как некроз мягких тканей или некроз кости, выявляются реже, чем рецидив опухоли, но клинически их иногда трудно различить. Хотя окончательные различия между некрозом и рецидивом опухоли могут также быть рентгенологически затруднены, результаты визуализации могут быть полезными в руководстве выбора лечения и оценки ответа на конкретное лечение.
Ожидаемые изменения тканей после лучевой терапии:
После облучения рака шеи, количество измененной тканей становятся видны на КТ и МРТ шеи. В течение первых 2 недель после лучевой терапии существует острая воспалительная реакция в глубоких тканях. Повышенная проницаемость приводит к интерстициальному отеку. После этого начального периода в несколько недель, наблюдается постепенное утолщение соединительной ткани. Распространение эндотелия также становится видимым, как полная обструкция сосудов со снижением венозного и лимфатического дренажа в результате дальнейшего накопления межклеточной жидкости. Увеличивается фиброз, но интерстициальный отек может уменьшиться путем возобновления оттока по капиллярным и лимфатическим каналам. Изменения видны на сканах пост-обработки КТ и МР изображений в зависимости от дозы облучения и скорости, объема облученной ткани и времени, прошедшего с окончания лучевой терапии [1,2].
Ожидаемые изменения тканей после лучевой терапии включают (рис 1 (а) - (j)):
- Утолщение кожи и подкожной мышцы.
- Cетчатость подкожно-жировой клетчатки и жировых слоев глубоких тканей.
- Отек в заглоточном пространстве.
- Повышенное накопление контраста в увеличенных слюнных железах, с последующим восстановлением размера этих желез: пострадиационный сиалоаденит.
- Атрофия лимфоидной ткани в лимфатических узлах и кольце Вальдейера-Пирогова.
- Утолщение и повышенное усиление стенки глотки.
- Утолщение структур гортани, с повышенной плотностью жира в преднадгортанном и парагортанном пространствах.
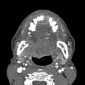
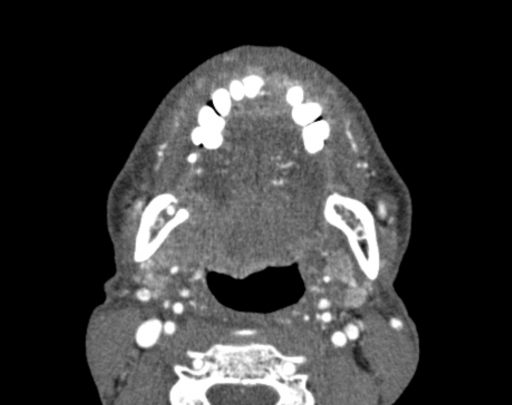
Уровень миндалин.
Перед RT (а): видна часть опухоли (стрелки).
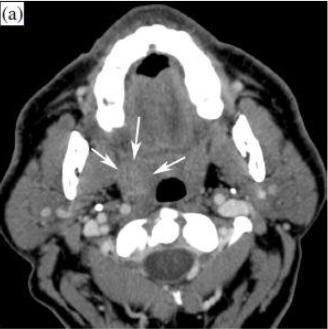
После RТ (b): ткани ротоглотки становятся симметричными. Уменьшение объема и повышение контрастности околоушных слюнных желез (звездочки) соответствуют постлучевому сиаладениту.
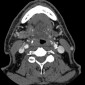
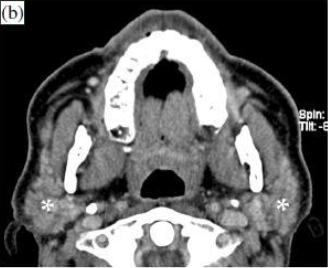
Уровень основания языка.
Перед RТ (с): асимметрия наблюдается в тканях основания языка, толще на правой стороне; это соответствует расширению опухоли вдоль основания языка в правой валлекуле (стрелки), и нормальной левой язычной миндалине (наконечники стрел). Видны несколько увеличенных лимфоузлов (звездочки).
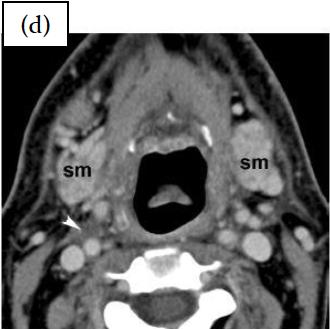
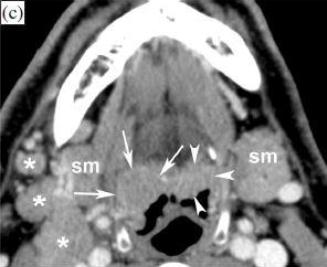
После RT (d): исчезновение опухолевых масс и аденопатии, с минимальными остатками лимфоидной ткани (стрелки). Примечание: признаки лучевого сиаладенита в обеих подчелюстных слюнных железах (SM).
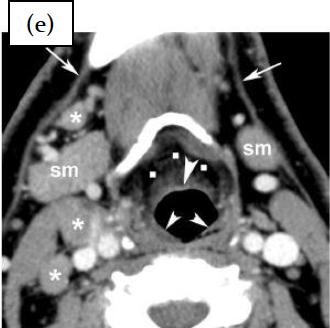
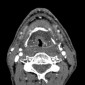
Уровень подъязычной кости.
Перед RТ (е): видно несколько увеличенных лимфоузлов (звездочки). Обратите внимание на нормальный вид подчелюстных слюнных желез (SM), надгортанника (стрелка) и черпало-надгортанных складок (маленькие стрелки), преднадгортаннового жирового пространства (точки) и подкожой мышцы (стрелки).
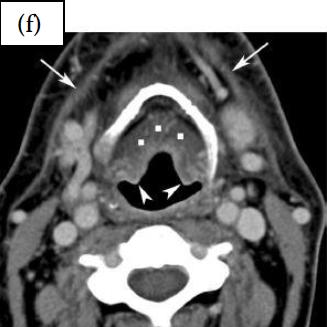
После RT (f), аденопатия исчезла; подчелюстные слюнные железы уменьшились за счет постлучевого сиаладенита. Видно утолщение надгортанника и черпало-надгортанных складок (наконечники стрел), а также уплотнение в преднадгортанном пространстве (точки). Обратите внимание на утолщение подкожной мышцы (стрелки).
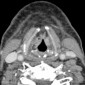
Уровень ложных голосовых связок.
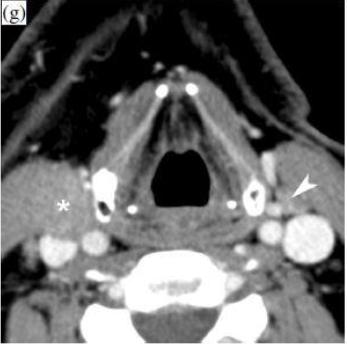
Перед RТ (g): лимфаденит виден справа (звездочка), нормального размера лимфоузел слева (стрелки).
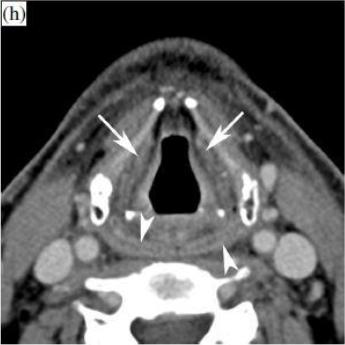
После RТ (h): лимфоузлы исчезли. В пределах гортани увеличение плотности видно в околоскладочном пространстве; стенки желудочков гортани стали утолщенными (стрелки). Имеется также утолщение и усиление задней гипофарингеальной стенки (головки стрелок).
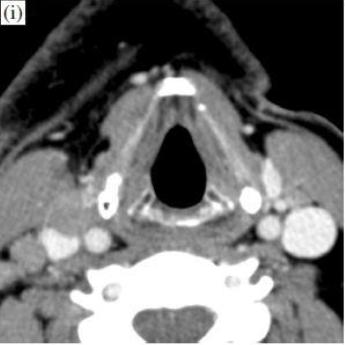
Уровень истинных голосовых связок.
Перед RT (i): на этом уровне можно видеть очень мало изменений.
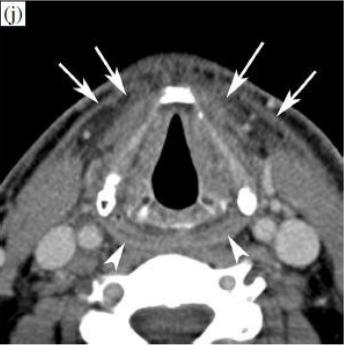
После RT (j): в гипофарингеальной стенке немного увеличилась накопление и утолщение (наконечники стрел). Более выраженные изменения видны в мягких тканях передних отделов шеи, показывая полосатую инфильтрацию жировых прослоек и утолщение подкожной мышцы (стрелки).
Эти изменения тканей наиболее выражены в первые несколько месяцев после окончания лучевой терапии, и уменьшаются или даже исчезают с течением времени. Важно отметить, что ожидаемые изменения тканей после лучевой терапии появляются симметрично, если шею не облучают с помощью асимметричного источника излучения.
Постлучевых изменений в хрящах гортани не происходит. Было описано снижение степени склероза хряща в окрестности опухоли, и это, думается, коррелирует с местным управлением [3].
Ожидаемые изменения тканей после операции:
Пределы хирургического лечения определяются балансом между излечением посредством радикальной резекции опухоли и необходимостью оставить пациента в функционально и эстетически приемлемой ситуации. Более обширные резекции возможны благодаря внедрению различных реконструктивных материалов, таких как пересадка на ножке или мягкие тканевые лоскуты, трансплантаты и протезы. Лоскуты на ножке могут быть собраны локально (в непосредственной площади дефекта), регионально (в том же районе, но не соприкасаются с дефектом) или на расстоянии от дефекта.
Наиболее часто используется отдаленная пластика, например лоскутом грудной мышцы, которая имеет отличное кровоснабжение и дает приемлемый функциональный и косметический результат. Метод широко используется для восстановления дефекта глотки после ларингэктомии с частичной фарингэктомией; также для закрытия дефектов после облучения шеи, так как позволяет использовать ткани со свежим кровоснабжением.
На КТ и МРТ лоскут грудной мышцы проявляется первоначально как громоздкая мягкотканная структура; постепенно атрофия и денервация приводит к потере массы и жировой дегенерации мышцы (рис. 2). При неполной денервации лоскута на сканах, он имеет мышечную волоконную структуру, и не стоит его путать с рецидивом опухоли.
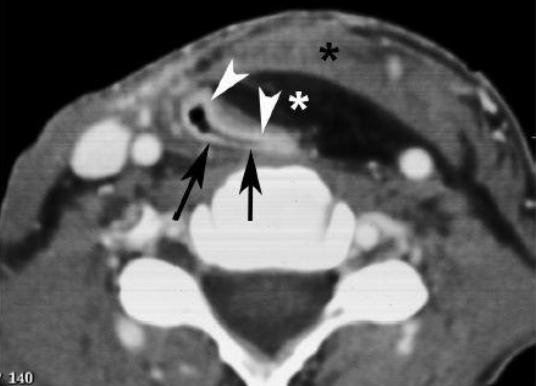
Рисунок 2. КТ с контрастным усилением. Состояние после полной ларингэктомии.
В средней трети шеи реконструируется неофарингс из остаточной ткани глотки (черные стрелки) и мышечного лоскута = лоскут грудной мышцы, содержащий кожу (наконечники стрел), подкожный жир (белая звездочка), и мышцы (черная звездочка).
Когда используется лоскут, васкуляризированный локальными сосудами с использованием микрохирургии, то такой лоскут называется свободным. Различные виды свободных лоскутов используются, например: кожные лоскуты, чтобы восстановить дефекты в ротовой полости, костные имплантанты (например, малоберцовой кости) для реконструкции нижнечелюстных дефектов, а также свободный участок тощей кишки для восстановления дефекта, созданного при тотальной ларингофарингэктомии.
Шейная диссекция - это хирургическая процедура для удаления шейных метастазов. различают несколько процедур.
Радикальная: одностороннее удаления блока из лимфатических узлов шеи уровней I-V [4], в том числе кивательной мышцы, внутренней яремной вены, подчелюстной железы и добавочного нерва (рис. 3).
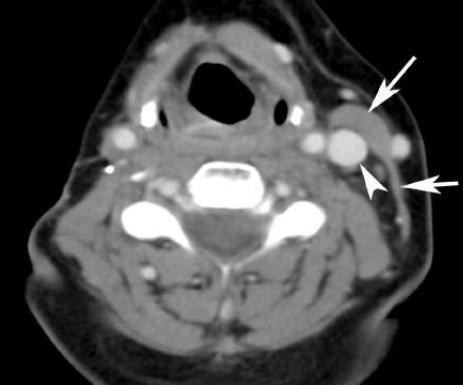
Рисунок 3. КТ с контрастным усилением. Потеря объёма мягких тканей в правой стороне шеи после радикальной шейной диссекции, включая резекцию кивательной мышцы и внутренней яремной вены (помечены стрелками и наконечник стрелы на здоровой стороне слева).
Если добавочный нерв сохраняется, процедура называется модифицированной радикальной диссекцией шеи. Иссечение правой кивательной мышцы может вызвать гипертрофию ипсилатеральной мышцы, поднимающей лопатку.
Если добавочный нерв и еще одна из выше упомянутых структур сохраняются, процедура называется функциональной или консервативной шейной диссекцией. Этот тип операции выполняется, когда нет аденопатии или есть клинически или рентгенологически небольшие метастатические лимфоузлы в области шеи.
При селективной шейной диссекции удаляется ограниченное число лимфатических узлов. Обычно выполняется операция по типу супраомохиоидальной диссекции: это включает в себя удаление узлов уровней I, II и III, и применяется при мелкоклеточном раке полости рта при отсутствии метастатических пораженных узлов (Рис. 4).
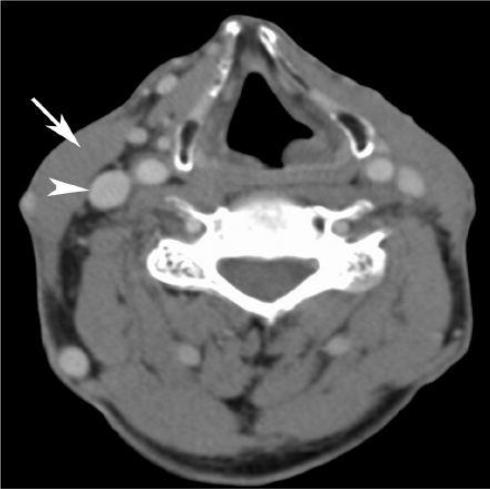
Рисунок 4. КТ с контрастным усилением. Состояние после селективной шейной диссекции слева с удалением лимфатических узлов под кивательной мышцей и окружающей жировой ткани, оставлена кивательная мышцы и внутренняя яремная вена (на здоровой стороне отмечены стрелкой и головкой стрелки).
Рецидив опухоли:
После лучевой терапии рецидив опухоли проявляется на КТ или МРТ как масса мягких тканей на первичном месте и/или в качестве увеличенных шейных лимфоузлов с центральным некрозом или без него. После хирургического лечения рецидив опухоли, как правило, появляется в виде мягкотканной массы вдоль поля хирургической резекции. Костную или хрящевую эрозию можно видеть при больших рецидивирующих опухолях. Также можно наблюдать периваскулярное или периневральное распространение опухоли.
В начале рецидива опухоль может быть трудно отличима от посттерапевтичеких изменений тканей. Таким образом, при высоком риске рецидива рекомендуется выполнить КТ или МРТ исследование после хирургического, лучевого или комбинированного лечения для новообразований головы и шеи головы [5,6]. Лучшее время для получения такого базового исследования составляет около 3-6 месяцев после окончания лечения. Сравнивая последующее исследования с базовым, возможно более достоверно обнаружить опухолевый рецидив или осложнения лечения на более ранней стадии, чем это можно определить при исключительно клиническом наблюдении за пациентом (рис. 5).
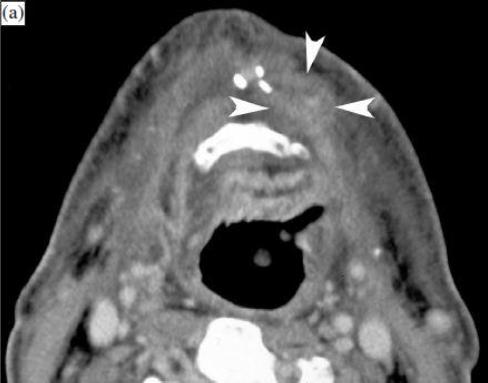
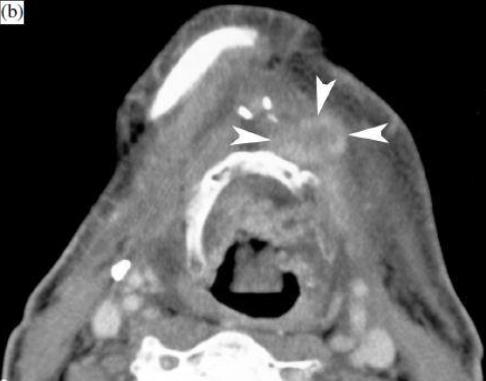
Рисунок 5, пациент после хирургического (краевая резекция нижней челюсти) и лучевого лечения левостороннего рака ротовой полости, примыкающего к нижней челюсти.
Базовое КТ-исследование через 6 месяцев после завершения терапии показывает ожидаемые посттерапевтические изменения, а также узловые изменения перед подъязычной костью, без четкого усиления (а, наконечники стрел); на основе этих выводов, было рекомендовано КТ-исследование в динамике.
Три месяца спустя, в том же месте видно более крупное и усиливающееся узловлое образование: подозреваемое по поводу рецидива опухоли (b, наконечники стрел). Клинически никаких признаков рецидива опухоли не было. На основании рентгенологических данных, резекция была выполнена примерно на месяц позже и рецидив опухоли подтвердился.
У большинства пациентов КТ является адекватным методом визуализации до и после лечения; МРТ является предпочтительной у пациентов с опухолями носоглотки, придаточных пазух носа и основания черепа.
Доказано, что само базовое исследование несет важную прогностическую информацию о местном результате: некоторые исследования показывают, что КТ может быть полезна в начале лечения для дифференциации пациентов, не реагирующих в ответ на облучение рака гортани и гортаноглотки [5,7]. В связи с этим, значение МРТ еще не применяется столь широко.
На основании проявлений рака гортани/глотки при КТ-исследовании в ранние сроки после лучевой терапии, прогнозирование долгосрочного результата может быть сделано в соответствии с баллами:
1 = ожидаемые после радиотерапии изменения, т.е. полное разрешение опухоли в основном месте и симметричное проявление постлучевых ожидаемых изменений гортани и гипофарингеальных тканей, как описано выше;
2 = фокусная масса с максимальным диаметром <1 см и/или асимметричная облитерация тканей гортанных пространств;
3 = фокусная масса с максимальным диаметром > 1 см, или <50% приблизительного уменьшения объема опухоли [3,5].
После лучевой терапии КТ с результатом 1 балл демонстрирует очень сильный предиктор положительного долгосрочного местного управления; такие пациенты, вероятно, не выиграют от дальнейших последующих визуальных исследований, рецидив не ожидается.
И наоборот, у пациентов с баллом 3 при первой контрольной КТ после облучения, прогноз плохой; почти у всех таких пациентов ожидается рецидив [3], и дальнейшее КТ-исследование в динамике у таких пациентов является оправданным. ФДГ или таллия контрастные ПЭТ или ОФЭКТ могут оказаться полезным промежуточным шагом в тех случаях, когда биопсия считается слишком рискованной, или если результат биопсии отрицателен. Действительно, прогностическая ценность отрицательной биопсии для местного управления, как сообщается, верна только в 70% [8]; это, вероятно, связано с ошибкой выборки, так как рецидив опухоли изначально развивается в подслизистой и следовательно, биопсия не может быть точно нацелена. В случаях противоречия между клиническими данными и результатами КТ, результатами радионуклидных исследований и/ или биопсии, необходимо частое клиническое наблюдение и динамика КТ/МРТ-исследований.
Рисунок 5, пациент после хирургического (краевая резекция нижней челюсти) и лучевого лечения левостороннего рака ротовой полости, примыкающего к нижней челюсти.
Базовое КТ-исследование через 6 месяцев после завершения терапии показывает ожидаемые посттерапевтические изменения, а также узловые изменения перед подъязычной костью, без четкого усиления (а, наконечники стрел); на основе этих выводов, было рекомендовано КТ-исследование в динамике.
Три месяца спустя, в том же месте видно более крупное и усиливающееся узловлое образование: подозреваемое по поводу рецидива опухоли (b, наконечники стрел). Клинически никаких признаков рецидива опухоли не было. На основании рентгенологических данных, резекция была выполнена примерно на месяц позже и рецидив опухоли подтвердился.
Балл 2 при постлучевой КТ изначально классифицируется как неопределенный, и КT необходима через 3-4 месяца в течение до 2 лет после окончания лучевой терапии (рис. 6).
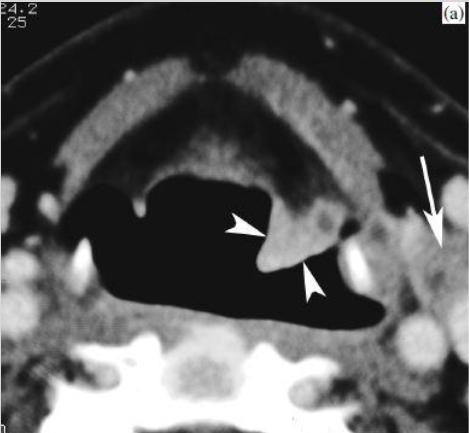
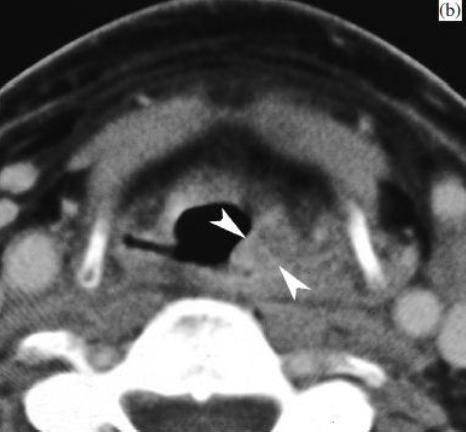
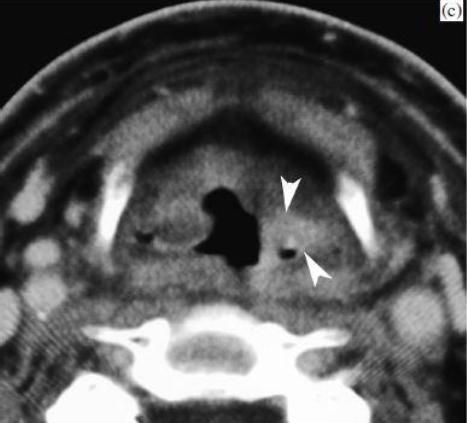
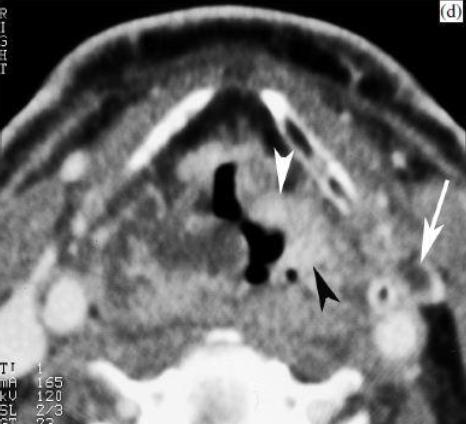
Рис. 6 (а) КТ до лечения: пациент с надгортанным плоскоклеточным раком T2, поражение в левой черпало-надгортанной складке (наконечники стрел). Патологический лимфоузел вдоль левой внутренней яремной вены (стрелка).
(б) три месяца после лучевой терапии. Клиническое обследование показало отек гортани, но нет доказательств рецидива опухоли. На КТ: утолщение надгортанных мягких тканей, более выраженное в левой черпало-надгортнной складке (наконечники стрел); плотность в ней также несколько выше, чем в окружающих тканях. Это неспецифическая находка (оценка 2), необходим дальнейший КТ-контроль.
(с) Через девять месяцев после лучевой терапии. Клинически благоприятная эволюция. Тем не менее, КТ показывает более выраженное повышение в левой черпало-надгортанной складке по сравнению с предыдущим исследованием (наконечники стрел). Вывод: изменения, подозрительные на рецидив опухоли. Прямая ларингоскопия была выполнена, но без изменений слизистых; результаты биопсии были отрицательными.
(г) Через год после лучевой терапии. Помимо увеличение общего отека гортани, усиленная масса в левой черпало-надгортанной складке распространяется кпереди на левое околосвязочное пространство (стрелки). Обратите внимание на небольшой некротический лимфоузел в шее слева (стрелка). Прямая ларингоскопия выполняется после изучения КТ, демонстрирует спекание некротических тканей над левой черпало-надгортанной складкой, подозрительное на рецидив опухоли. Биопсия показала плоскоклеточный рак. Пациент умер от прогрессирования 7 месяцев спустя.
Некоторые авторы рекомендуют ФДГ-ПЭТ в качестве начального базового исследования у пациентов с неясным прогрессирующим заболеванием и с низким клиническим подозрением на рецидив, а также у пациентов с неспецифическими симптомами, которые могут указывать на рецидив, но без клинически очевидной массы; КТ должна быть выполнена при неоднозначных или положительных результатах ПЭТ-исследования, или в качестве исходного исследования у пациентов с подозрительной осязаемой массой или гистологически доказанным рецидивом опухоли [9]. Необходимы дальнейшие исследования, чтобы определить наиболее эффективное использование ПЭТ и КТ/МРТ в пост-обработке ситуаций; также должна быть оценена потенциальная роль системы комбинированной ПЭТ-КТ.
Потенциальное значение динамической визуализации:
Использование информации на основе КТ/МРТ изображений может привести к более скорому хирургическому лечению и потенциально улучшить выживание этих пациентов [5]. Тем не менее, доступны некоторые данные, касающиеся значения динамического наблюдения после лечения у пациентов с раком головы и шеи. Некоторые авторы утверждают, что регулярные осмотры незаменимы у пациентов с бессимптомными локорегионарными рецидивами, обнаруженными во время наблюдения, и имеют значительно лучший прогноз выживания, чем у пациентов с клинически выявленным рецидивом [10]. Другие авторы указывают, что большая выживаемость наблюдаемых по КТ/МРТ больных с рецидивом опухоли может быть связана с ранней диагностикой и ложно появляется большим выживанием [6]. Это утверждение, вероятно, справедливо для пациентов с комбинированной терапией распространенного рака головы и шеи, которые, как известно, вылечиваются плохо после рецидива и редко имеют эффективное лечение [11]. Тем не менее, если есть реальный шанс на спасение после локорегионарного рецидива (например этот показатель 35-60% при экстренно оказанной хирургической помощи для облученного рака гортани), КТ/МРТ-наблюдение стоит добавить как дополнение к клиническому наблюдению для дальнейшего улучшения выживаемости. Дополнительные исследования обязаны выяснить этот вопрос.
Осложнения после операции:
Большинство хирургических осложнений возникают в ранние сроки после лечения и рассматриваются на клинической базе. Визуализация может потребоваться для выявления и визуализации свищей, происходящих из полости рта или глотки. Многие из эти свищей закроются спонтанно, но некоторые потребуют повторных операций. КТ/МРТ могут также использоваться в подтверждение отторжения трансплантатов (некроз лоскута, рис. 7).
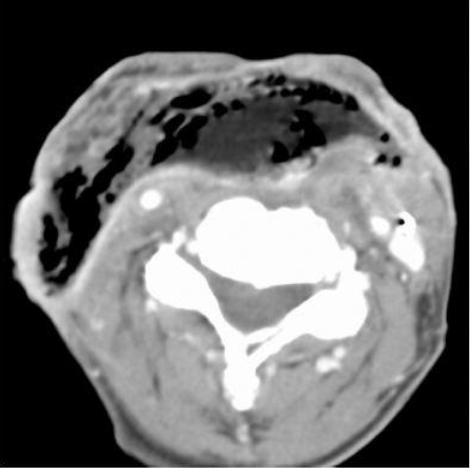
Рисунок 7. КТ с контрастным усилением. За несколько недель до этого исследования выполнена общая ларингэктомия, с реконструкцией неофарингса лоскутом грудной мышцы. Пациент страдает от стойких свищей. На протяжении грудного лоскута видны большие сливающиеся пузырьки газа, указывающие на некроз лоскута. Подтвержден хирургически.
Осложнения после лучевой терапии:
Острые осложнения лучевой терапии (кожа и слизистые реакции) могут произойти во время или сразу после лечения и обычно разрешаются спонтанно. Некроз тканей является редким осложнением лучевой терапии в области головы и шеи, и, как правило, проявляется от нескольких месяцев до нескольких лет после окончания лучевой терапии. Определены несколько факторов риска, в том числе высокие дозы радиации и большие радиационные поля. Может возникнуть некроз мягких тканей, хрящей и костей; могут быть вовлечены несколько типов тканей одновременно.
Нижнечелюстной остеорадионекроз
Остеорадионекроз может включать нижнюю челюсть, окостеневший хрящ гортани, височную кость и подъязычную кость [12,13]. Патогенез не полностью понятен. Популярна теория, что облучение вызывает гипоксию, гипоцеллюлярность и гиповаскулярность ткани, кость не в состоянии реконструировать последующие потери ткани, что приводит к разрушению [14]. Травма часто связана с проявлением остеонекроза, так как это создает спрос на восстановление кости за пределами возможностей облученной ткани. Результаты КТ включают костные разрушения (корковую деструкцию, прерывистость и потерю губчатой трабекулярности), связанные с патологическими переломами костей, утолщение мягких тканей (иногда содержит пузырьки газа) и формирование свищей (рис. 8).
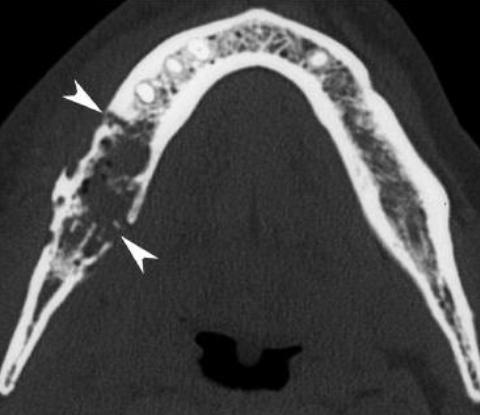
Рисунок 8 КТ, костное окно. Пациент с 10-летней давностью лучевой терапии по поводу рака правой околоушной железы, в настоящее время жалобы на боли и обнажение слизистой. Обширное рассасывание губчатой ткани в нижней челюсти справа (по сравнению с противоположной стороной), и деструкция язычного и щечного коркового слоя, осложненная патологическим переломом (наконечники стрел). Интракостные пузырьки воздуха. Гистопатологическое исследование показало некроз кости с признаками остеомиелита.
Рентгенологическая дифференциация некроза от рецидива опухоли может быть трудной. В нижней челюсти ассоциация с корковыми дефектами вдали от исходной опухоли (с щечной поверхности или в противоположной стороне челюсти) поможет поставить диагноз нижнечелюстного остеорадионекроза [15].
Помимо кортикальной деструкции, МРТ также покажет изменение интенсивности сигнала костного мозга в пораженной остеорадионекрозом части нижней челюсти, с ненормально однородной низкой интенсивностью сигнала на T1-взвешенных изображениях; с увеличением интенсивности сигнала на T2-взвешенных изображениях. Патологически измененный костный мозг покажет диффузное и интенсивное повышение после внутривенного введения контрастного вещества [16,17].
Некроз гортани
Сохранение выраженного отека и радионекроза после лучевой терапии рака гортани является редким осложнением лечения, с частотой около 1%. Пик возникновения некроза гортани приходится на первые 12 месяцев после лечения, и более или менее совпадает с пиком рецидива опухоли. Тем не менее, случаи некроза гортани происходит и спустя 10 лет после лучевой терапии [18]. Эти отдаленные постлучевые последствия связаны с нарушениями сосудистого и лимфатического снабжения, вызванными фиброзом и повреждением эндотелия [19].
Сам хрящ устойчив к воздействию облучения (смотри выше). Изменения хряща обычно возникают при повреждении надхрящницы травмой или опухолью [20]; это может привести к инфекционному перихондриту, а он в свою очередь - к некрозу и деструкции гортани. Пациенты с некрозом гортани часто имеют боль в шее и/или боль в ухе, некоторую степень дисфагии, и отек передних отделов шеи. Охриплость и одышка вызваны увеличением отека с нарушением подвижности голосовых связок. Могут быть воспалительные изменения в свище или коже, покрывающей дефект. Пальпация гортани области обычно болезненная.
На КТ/МРТ исследованиях виден тот или иной объём отека мягких тканей гортани [13]. Эти изменения тканей, окружающих некротический хрящ, могут быть очень выраженными и представлять собой единственную видимую патологию, что делает дифференцировку с рецидивирующей опухоли очень сложной. Кроме того, возможно одновременное наличие некроза гортани и рецидива опухоли. При некрозе гортани можно увидеть некоторое количество жидкости в перихондральных тканях. Повреждение хряща видны часто, но у некоторых пациентов они могут стать очевидными только на последующих КТ-исследованиях. Некроз щитовидного хряща может привести его к фрагментации и деструкции с или без пузырьков газа в прилегающих тканях (рис. 9).
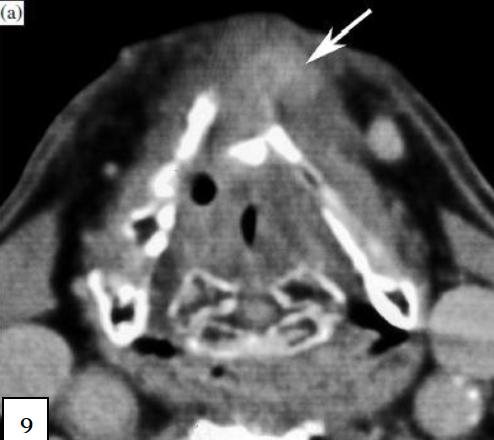
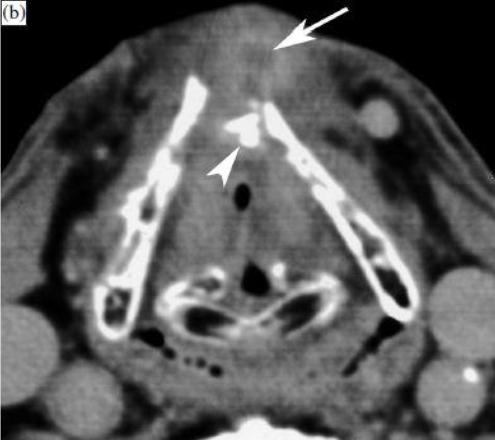
Рисунок 9, пациент с охриплость, одышкой и болью в гортанной области, 14 лет после лучевой терапии при раке гортани. Сканы КТ (скан b на 5 мм ниже скана а) демонстрируют фрагментацию передней части щитовидного хряща (стрелки), утолщение интра- и экстрагортанных мягких тканей, в том числе небольшой предгортанной усиливающейся области с центральной жидкостной плотностью, возможно, соответствующей небольшому абсцессу (стрелка). Это исследование было представлено как подозрительное на некроз гортани. Исследование ФДГ-ПЭТ было отрицательным. Было начато консервативное лечение с постепенным улучшением симптомов; такая эволюция изменений подтверждает гипотезу ограниченного некроза гортани.
У пациентов с некрозом черпаловидных хрящей возможна передняя дислокация этого хряща, что может быть связано с перстневидно-черпаловидным отеком, вторичным по отношению к воспалению или инфекции. Возможен прогрессивный лизис черпаловидного хряща, показывающий картину от фрагментации хряща до полного его исчезновения [21].
Были описаны случаи попадания фрагментов хрящей в дыхательные пути [13]. Возможен склероз перстневидного хряща, в том числе одномоментно с лизисом щитовидного хряща.
На МРТ некроз гортани может выглядеть как фокусный отек мягких тканей гортани, с потерей нормального высокого сигнала в медуллярном пространстве окостеневшего гортанного хряща на T1-взвешенных изображениях, и повышение сигнала патологически измененного хряща после инъекции гадолиния [22]. В некоторых случаях, результаты обработки изображений позволяют лучше дифференцировать между рецидивом опухоли и хондронекрозом в сравнении с результатами только клинического обследования. Исследования постлучевых наблюдений рака гортани и гортаноглотки [3,7] показали, что прогрессивные изменения хряща на постлучевой КТ помогают прогнозировать местный исход, связанный с рецидивом опухоли или хондрорадионекрозом: пузырьки газа в непосредственной близости от распада хряща имелись при некрозе и отсутствовали при рецидиве опухоли. Тем не менее, сосуществующий с некрозом рецидив опухоли трудно исключить при изменениях тканей гортани (рис. 10).
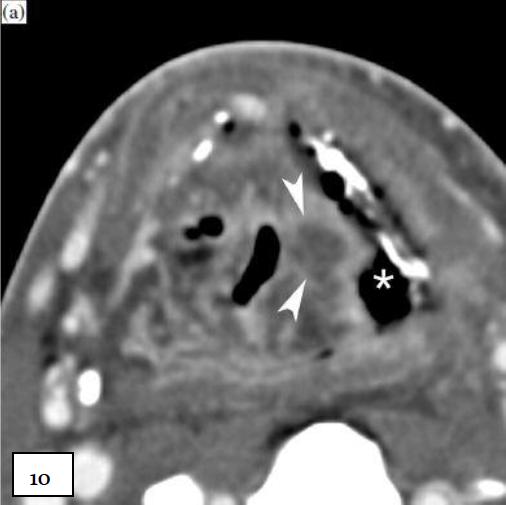
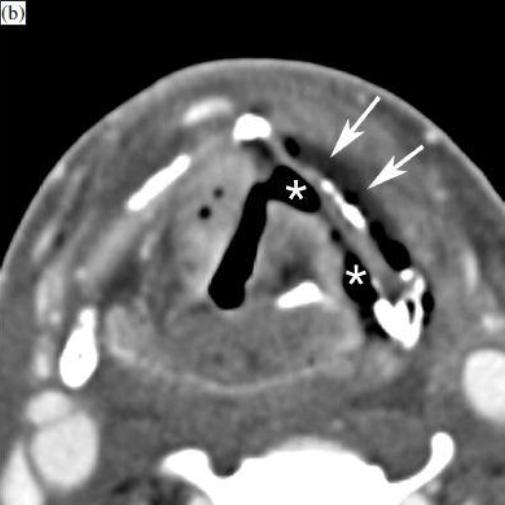
Рисунок 10, КТ с контрастным усилением. Пациент спустя 5 месяцев после облучения при T3 надгортанном раке, в настоящее время жалобы на прогрессирующую дисфагию. Ларингоскопия показывает фиксированную влево голосовую складку, подозревается рецидив опухоли.
(а) На фоне ожидаемых изменений после лучевой терапии, определяется центральное гиподенсное узловое изменение утолщенных мягких тканей в левой черпало-надгортанной складке (наконечники стрел). Имеется большой мягкотканный дефект (звездочка), соединяющий левый грушевидный синус с обнаженной пластиной щитовидного хряща, которая имеет неравномерную толщину и окружена пузырьками воздуха.
(б) На более низком скане определяются дефекты мягких тканей у левого грушевидного синуса, а также у желудочка гортани (звездочки). Обратите внимание на слой жидкости на внешней стороне щитовидного хряща (стрелки). Исследование ФДГ-ПЭТ было явно положительным на надскладочном уровне. На фоне быстро ухудшающейся клинической ситуации, проведена общая ларингэктомия. Гистологическое обследование выявило обширный некроз тканей, без признаков рецидива опухоли гортани.
Было высказано предположение, что ФДГ-ПЭТ может дифференцировать между рецидивом опухоли и постлучевым некрозом тканей [23,24]. Однако ложно положительные результаты также возможны, так как некроз тканей может быть связан с воспалительной реакцией, повышением обмена веществ, что увеличивает поглощение трейсера.
Другие осложнения после лучевой терапии
Фиброз после лучевой терапии может привести к сокращению и уплотнению шейных тканей. Фиброз-индуцированная гортанная дисфункция может привести к аспирации вследствие иммобилизация надгортанника и/или замедленного закрытия преддверия гортани и голосовой щели. Дисфагия может быть вызвана стенозом глотки, которая чаще всего проявляется в неофарингсе после тотальной ларингэктомия. Фиброз жевательных мышц может возникнуть, в частности, если они были вовлечены в опухоль.
Сигнальные МРТ-характеристики фиброза являются непостоянными; часто необходимы последующий исследования в динамике, чтобы исключить рецидив с достаточной степенью уверенности. Прочие долгосрочные осложнения лучевой терапии включают артериопатию, задержку центральной реакции нервной системы, постлучевую миелопатию, паралич черепных нервов и метастазы [25].
Заключение:
Последующая обработка КТ или МРТ представляет ценность, когда подозревается рецидив опухоли, чтобы подтвердить наличие поражения и определить его степень. Реже лучевая визуализация может быть полезна в дифференциации между рецидивом опухоли и осложнениями лечения. У больных с высоким риском рецидива опухоли после лечения, КТ/МРТ имеет значение для наблюдения за пациентом в качестве дополнения к клиническому наблюдению. Базовое КТ/МРТ исследование должно быть получено в сроки от 3 до 6 месяцев после окончания терапии. Доказано, что рецидивы опухоли при этом могут быть обнаружены ранее клинических проявлений.
Ключевые моменты:
- Облучение вызывает изменения тканей на постлучевых КТ/МРТ, необходимо уметь дифференцировать постлучевые осложнения от рецидива опухоли.
- Раннее выявление рецидивной опухоли облегчается при выполнении базового КТ/МРТ исследования в сроки от 3 до 6 месяцев после терапии.
- Некроз тканей после лучевой терапии трудно дифференцировать от рецидивной опухоли; в таких обстоятельства, управление пациентом зависит от комбинации результатов клинического и КТ-наблюдения, в том числе в динамике.
- Результаты биопсии могут быть ложно-отрицательными в случаях рецидива опухоли; в случае противоречия между клинической картиной, результатами лучевой визуализации и/или биопсией, необходимо контрольное КТ/МРТ наблюдение в краткий период с регулярной динамикой.
Автор
Роберт Германс
Отдел радиологии, университетская больница Левен, Herestraat 49, B-3000 Левен, Бельгия
Адрес: Роберт Германс, Отдел радиологии, Университет Больницы Левена, Herestraat 49,
B-3000 Левен, Бельгия. Тел .: + 32-16-343781; факс: + 32-16-343765;
Электронная почта: robert.hermans@uz.kuleuven.ac.be
Дата принятия к публикации 18 января 2004
Литература
- Mukherji SK, Mancuso AA, Kotzur IM et al. Radiologic appearance of the irradiated larynx. Part I. Expected changes. Radiology 1994; 193: 141–8.
- N¨omayr A, Lell M, Sweeney R et al. MRI appearance of radiation-induced changes of normal cervical tissues. Eur Radio 2001; 11: 1807–17.
- Pameijer FA, Hermans R, Mancuso AA et al. Pre- and post-radiotherapy computed tomography in laryngeal cancer: imaging-based prediction of local failure. Int J Radiat Oncol Biol Phys 1999; 45: 359–66.
- Som PM, Curtin HD, Mancuso AA. An imaging-based classification for the cervical nodes designed as an adjunct to recent clinically based nodal classifications. Arch Otolaryngol Head Neck Surg 1999; 125: 388–96.
- Hermans R, Pameijer FA, Mancuso AA et al. Laryngeal or hypopharyngeal squamous cell carcinoma: can follow-up CT after definitive radiotherapy be used to detect local failure earlier than clinical examination alone?. Radiology 2000; 214: 683–7.
- Schwartz DL, Barker J Jr, Chansky K et al. Postradiotherapy surveillance practice for head and neck squamous cell carcinoma—too much for too little?. Head Neck 2003; 25: 990–9.
- Mukherji SK, Mancuso AA, Kotzur IM et al. Radiologic appearance of the irradiated larynx. Part II. Primary site response. Radiology 1994; 193: 149–54.
- Keane TJ, Cummings BJ, O’Sullivan B et al. A randomized trial of radiation therapy compared to split course radiation therapy combined with Mitomycin C and 5 Fluorouracil as initial treatment for advanced laryngeal and hypopharyngeal squamous carcinoma. Int J Radiat Oncol Biol Phys 1993; 25: 613–8.
- Mukherji SK, Wolf GT. Evaluation of head and neck squamous cell carcinoma after treatment (editorial). Am J Neuroradiol 2003; 24: 1743–6.
- de Visscher AV, Manni JJ. Routine long-term follow-up in patients treated with curative intent for squamous cell carcinoma of the larynx, pharynx and oral cavity. Arch Otolaryngol Head Neck Surg 1994; 120: 934–9.
- Cooney TR, Poulsen MG. Is routine follow-up useful after combined-modality therapy for advanced head and neck cancer?. Arch Otolaryngol Head Neck Surg 1999; 125: 379–82.
- Hermans R, Fossion E, Ioannides C et al. CT-findings in osteoradionecrosis of the mandible. Skelet Radiol 1996; 25: 31–6.
- Hermans R, Pameijer FA, Mancuso AA et al. Computed tomography findings in chondroradionecrosis of the larynx. Am J Neuroradiol 1998; 19: 711–8.
- Marx RE. Osteoradionecrosis: a new concept of its pathophysiology. J Oral Maxillofac Surg 1983; 41: 283–8.
- Hermans R. Imaging of mandibular osteoradionecrosis. Neuroimag Clin North Am 2003; 13: 597–604.
- Bachmann G, R¨ossler R, Klett R et al. The role of magnetic imaging and scintigraphy in the diagnosis of pathologic changes of the mandible after radiation therapy. Int J Oral Maxillofac Surg 1996; 25: 189–95.
- Chong J, Hinckley LK, Ginsberg LE. Masticator space abnormalities associated with mandibular osteoradionecrosis: MR and CT findings in five patients. Am J Neuroradiol 2000; 21: 175–8.
- O’Brien PC. Tumour recurrence or treatment sequelae following radiotherapy for larynx cancer. J Surg Oncol 1996; 63: 130–5.
- Alexander FW. Micropathology of radiation reaction in the larynx. Ann Otol Rhinol Laryngol 1963; 72: 831–41.
- Keene M, Harwood AR, Bryce DP et al. Histopathological study of radionecrosis in laryngeal carcinoma. Laryngoscope 1982; 92: 173–80.
- De Vuysere S, Hermans R, Delaere P et al. CT findings in laryngeal chondroradionecrosis. J Belge Radiol 1999; 82: 16–8.
- Bousson V, Marsot-Dupuch K, Lashiver X et al. N´ecrose postradique du cartilage crico¨ıde: un cas inhabituel. J Radiol 1995; 76: 517–20.
- Anzai Y, Carroll WR, Quint DJ et al. Recurrence of head and neck cancer after surgery or irradiation: prospective comparison of 2-deoxy-2-[F-18]fluoro-D-glucose PET and MR imaging diagnoses. Radiology 1996; 200: 135–41.
- McGuirt WF, Greven KM, Keyes JW Jr et al. Laryngeal radionecrosis versus recurrent cancer: a clinical approach. Ann Otol Rhinol Laryngol 1998; 107: 293–6.
- Becker M, Schroth G, Zb¨aren P et al. Long-term changes induced by high-dose irradiation of the head and neck region: imaging findings. RadioGraphics 1997; 17: 5–26.