Введение
Аневризмы висцеральных ветвей аорты редкая патология, частота встречаемости которой по данным рутинной аутопсий и неинвазивных методов диагностики не превышает 0.1-2% [1, 2]. Первые упоминания о аневризме печёночной артерии встречаются у J. Wilson в 1809 г., в протоколе аутопсии 50-и летнего священника погибшего от разрыва «полости связанной с левой печеночной артерией» (приведено по Guida P.M. и Moore S.W.[3]). В 1847 г. E. Crisp, изучая описания 591 случаев аневризм висцеральных ветвей, не находит среди них ни одного случая аневризмы печеночной артерии [4, 5]. В 1891 г. Hale White впервые описывает триаду клинических признаков сопутствующих заболеванию, к которым относятся боль в правом верхнем квадранте живота, желудочно-кишечное кровотечение и желтушность кожных покровов, которые по сей день используются для первичной диагностики данной патологии[6-9]. К 1895 г. был зарегистрирован 21 случай аневризм печеночной артерии, ни один из которых не был диагностирован прижизненно и каждый из которых привел к гибели пациента[6]. Первый опыт успешного лечения известен с 1903 г., когда H. Kehr впервые проводит лигирование аневризмы печеночной артерии с прорывом в желчный пузырь[10]. В 1943 г. G. Gordon Taylor впервые применяет методику аневризмографии[11]. Таким образом к 1954 г. известно о 100 клинических наблюдениях аневризмы печеночной артерии, но лишь в двух случаях диагноз был выставлен до операции [12, 13].
Hepatic artery aneurysm is a rare condition that is life-threatening if not diagnosed and treated promptly. Due to the wide incorporation of high-tech methods of diagnosis in medical practice, it is now possible to diagnose patients early, provide care and, as a result, increase the survival rate. Based on the review of articles published in foreign medical journals, authors highlight the role of radiological methods in the diagnosis of this pathology and present a case report showing their application. The present clinical case demonstrates the possibilities of diagnosis and treatment, as well as difficulties caused primarily rarity of diseases.
Морфология и этиопатогенез.
Под аневризмой следует понимать локальное расширение диаметра сосуда в 1,5 раза по сравнению с его не расширенным участком. В зависимости от механизма формирования аневризмы их разделяют на истинные и ложные. Истинные аневризмы развиваются при аномалиях стенки сосуда, в результате чего происходит расширение и истончение всех её трех слоев. В начале прошлого века считалось что основным этиологическим фактором приводящим к формированию истинных аневризм является грибковое поражение, однако в настоящее время большая роль отводится атеросклеротическим изменениям стенок, особенно при наличии таких факторов риска как длительная гипертензия, дислипидэмия, курение и пр. Так при анализе 300 публикаций F.T. Curran и S.A. Taylor отмечают, что частота встречаемости атеросклеротических изменений, как первичных так и вторичных, составляется до 32%. Среди других факторов авторы приводят примеры фибромышечной дисплазии, системных васкулитов, заболеваний соединительной ткани, инфекции, а так же травмы и посттравматические изменений, частота же микотических поражений не превышает 4 % [14].
Пусковым фактором в формировании ложных аневризм в настоящее время считается повреждение в виде разрыва внутреннего и среднего слоев стенок сосуда (интимы и медии) с отграничением крови адвентицией или окружающими периваскулярными тканями (например в результате панкреатита, аутоимунного или механического повреждения стенки во время эндоваскулярного, лапароскопического или хирургического вмешательства) [15]. В пример можно привести травмирование интимы с расслоением сосудистой стенки, как редкого осложнения при хирургической установке интраартериального порта для проведения регионарной химиотерапии при паллиативном лечении нерезектабельных раков или метастатического поражения печени [16].
В большинстве публикаций приводятся данные, что среди всех случаев висцеральных аневризм частота встречаемости аневризмы селезеночной артерии составляет 60%, затем по частоте следуют аневризмы печеночной артерии (20%). Однако в комплексном ретроспективном обзоре литературы и клинических наблюдений за период с 1985 по 1995 проведенный в 2002 году в клинике Mayo, среди всех аневризм висцеральных ветвей авторы описывают 103 случая аневризмы печеночной артерии и 83 случая аневризм селезеночной артерии [17]. Данные изменения соотношения авторы связывают, во-первых, с тенденцией к более широкому использованию чрескожных диагностических и терапевтических манипуляций, во-вторых, с более широким применением компьютерной томографии при тупых травмах брюшной полости, в результате чего увеличилось число случайных находок «скрытых» аневризм, не проявляющих себя клинически [18, 19].
По морфологии аневризмы печеночной артерии могут быть классифицированы как веретенообразные и мешотчатые. По локализации чаще поражается правая печеночная артерия (47%), затем следует общая печеночная артерия (22%), собственно печеночная артерия (16%), левая печеночная артерия (13%) и пузырная артерия (1%) [18].
Диагностика.
Аневризмы печеночной артерии в большинстве случаев диагностируют случайно в результате обследования пациента по поводу неспецифических абдоминальных болей или какого-либо сопутствующего заболевания [20]. В некоторых наблюдениях на обзорных снимках определяется кольцо кальцификации в области правого подреберья [21, 22]. При рентгеноскопии с барием заболевание можно заподозрить по деформации двенадцатиперстной кишки за счет вне органного сдавления объемным образованием[23]. При проведении эзофагогастродуоденоскопии (ЭГДС) аневризма может симулировать подслизистое образование двенадцатиперстной кишки, выступающее в просвет, при образовании аневризмодуоденальной фистулы на вершине образования может определяется эрозия или язва [24].
Ультразвуковая картина вариабельна, она зависит от размеров аневризматического мешка и степени его тромбирования[25]. Истинная аневризма чаще представляет собой гипоэхогенное округлое однокамерное образование прилежащее к печеночной артерии, наличие нескольких камер в образовании указывает на ложную аневризму. Цветовое доплеровское картирование при наличии признака «инь - янь» (за счет высокоскоростного движения крови «туда и обратно») в области шейки позволяет отдифференцировать ложные аневризмы от истинных, однако данный паттерн так же может встречаться и при истинной мешотчатой аневризме, в данном случае анализ изображений в клиническом контексте (анамнез) позволяет дифференцировать ложные аневризмы от истинных мешотчатых[26]. УЗИ является ценным диагностическим инструментом для выявления аневризм за счет легкой доступности, незнвазивности, дешевизны, быстроты получения результатов, а так же отсутствия ионизирующего излучение и необходимости применения контрастных веществ. Метод имеет чувствительность 94% и специфичность 97% в обнаружении аневризм[27]. Однако данный метод является оператор-зависимым, а получение данных у пациентов в тяжелом состоянии может быть затруднено[26].
Мультидетекторная компьютерная томография является ценным инструментом, позволяющим уточнить топографо-анатомическое взаимоотношение аневризмы с окружающими структурами, изучить анатомию сосудов, получить информацию состоянии сосудистой стенки, оценить состояние окружающих тканей и спланировать тактику и объем предстоящего вмешательства. Истинные аневризмы при компьютерной томографии аневризмы, как правило, имеют веретеновидную форму, часто распространяются на значительную длину, с вовлечением всей окружности и всех трех слоев стенки сосуда. Ложные аневризмы обычно имеют мешотчатую форму с узкой шейкой, имеют гладкие хорошо отграниченные стенки, представленные отграничением крови адвентицией или окружающими периваскулярными тканями. Наличие иррегулярных стенок с нечеткими границами, широкой шейки позволяет предположить микотическую природу аневризмы. При неусиленном исследовании аневризма может выглядеть как изоденсивная округлая структура прилежащая к сосуду. Введение контрастного вещества показывает заполнение просвета аневризматического мешка, а отсутствие его полного наполнения может указывать на наличие пристеночных тромботических масс[26]. Компьютерная томография в отличии от УЗИ является оператор-независимым методом и имеет более короткое время получения диагностических изображений. Однако постобработка исходных данных и создание трехмерных реконструкций может быть трудоемкой и требует наличия специализированного программного обеспечения на рабочей станции врача. Компьютерная томография обеспечивает оценку всего сосудистого русла, в то время как субстракционная ангиография ограничена выбранным сосудистым бассейном, однако в отличии от нее обладает меньшим пространственным разрешением [28]. В исследовании J. A. Soto и др [29], чувствительность и специфичность метода составила 95,1% и 98,7%.
Осложнения.
Наиболее тяжелым осложнением данного заболевания является разрыв аневризмы с развитием желудочно-кишечного кровотечения и геморрагического шока, приводящих к летальному исходу. Прорыв крови может происходить в брюшную полость (43%), в просвет желудка и двенадцатиперстной кишки (11%), в желчные протоки (41%) или в воротную вену (5%) [30]. Риск разрыва при диаметре аневризмы более 2 см достигает 50%, а общая смертность вследствие разрыва приближается к 70% [15]. Увеличение диаметра аневризмы при выборе нехирургической тактики ведения отмечено в 27% случаев и составило до 0,8 см в течении трех лет [17]. Кроме того, отмечено что риск разрыва аневризм возникших в результате неатеросклеротических изменений гораздо выше. Вследствие высокой частоты спонтанного разрыва при аневризмах более 2 см в диаметре показано оперативное лечение [31].
Лечение.
Методом первого выбора в лечении аневризм печеночных артерий являются рентгеноэндоваскулярные вмешательства. Выбор стратегии лечения зависит от локализации аневризмы. Аневризмы ветвей печенонй артерии, как правило, заполняются отделяемыми спиралями или специальными клеями (например Onyx) без риска ишемии паренхимы, в виду двойного кровоснабжения печени. Аневризмы общей печеночной артерии могут быть выключены из кровотока спиралями дистальнее и проксимальнее шейки аневризмы, при этом гастродуоденальная артерия обеспечит собственную печеночную артерию достаточным кровотоком. Аневризмы собственной печеночной артерии и ее бифуркации должны быть исключены из кровотока с сохранением проходимость сосуда. При широкой шейке аневризмы возможно применение баллон ассистирующей технологии, когда отделяемые спирали удерживаются в ее полости с помощью раздутого баллонного катетера. В литературе есть несколько сообщений об успешной имплантации перенаправляющих поток стентов для исключения из кровотока аневризмы. После выполнения эндоваскулярной процедуры рекомендуется контрольное исследование через месяц и через полгода[32].
В отечественной литературе описания случаев аневризм печеночной артерии единичны [33, 34]. Учитывая редкость данной патологии, а также то, что клиническая картина не обладает выраженной специфичностью и диагностика до развития угрожающих жизни пациента осложнений сложна, приводим собственное клиническое наблюдение.
Пациент 44 лет доставлен по каналу скорой медицинской помощи в приемное отделение ГКБ№71 ДЗ г. Москвы с жалобами на выраженную слабость, головокружение и неоднократные потери сознания в течении двух недель. В последние 4 дня отмечает появление стула черного цвета. Накануне присоединились боли в области сердца не купируемые самостоятельно, в связи с чем обратился за медицинской помощью.
При поступлении состояние стабильно тяжелое. Пациент в сознании, контактен, адекватен. Кожные покровы бледные. Гемодинамика стабильная. Из лабораторных данных обращает внимание нормохромная анемия. При проведении ЭГДС в просвете желудка умеренное количество «кофейной гущи» и пищи. Привратник проходим, луковица двенадцатиперстной кишки деформирована – по верхней стенке имеется сдавление из вне до 2/3 просвета без признаков самостоятельной или передаточной пульсации, на вершине которого определяется язвенный дефект размерами до 0.5 см с фибрином на дне.
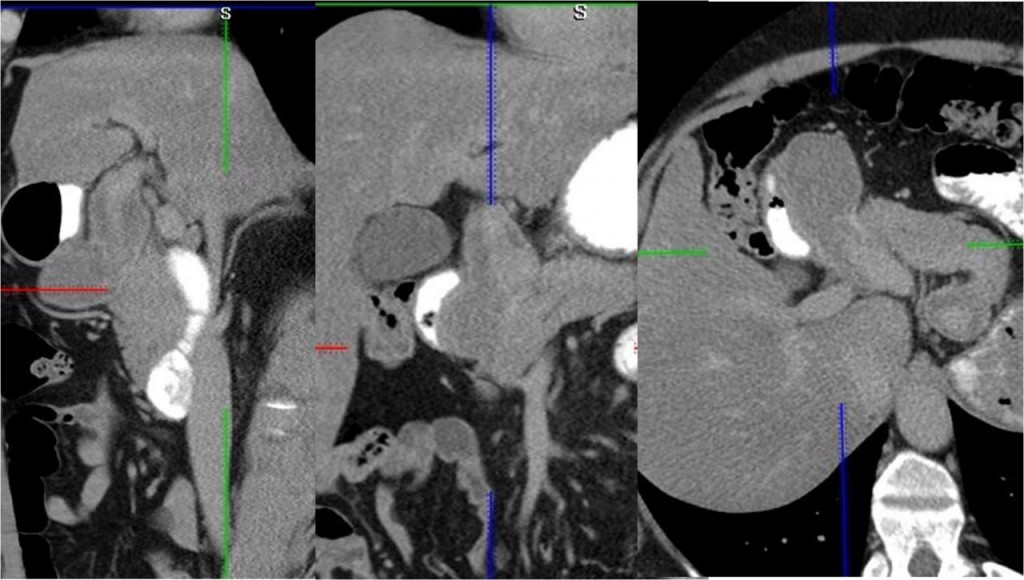
При УЗИ брюшной полости в проекции пилорического отдела и луковицы двенадцатиперстной кишки определяется объемное образование неоднородной эхоструктуры, размерами 56х36х57 мм. При ЦДК образование аваскулярно, определяется передаточная пульсация, дистальнее образования - общая печеночная артерия.
При компьютерной томографии брюшной полости с болюсным контрастным усилением по стандартному 3-х фазному протоколу выявлено расширение и извитость ветвей чревного ствола: общая печеночная артерия (до уровня ворот печени) до 15 мм, утолщение стенок до 5 мм, селезеночная артерия до 11 мм с утолщением стенок до 13 мм. В области луковицы двенадцатиперстной кишки определяется округлое образование до 35 мм, оттесняющее кишку, не отделимое по дорсальному контуру от печеночной артерии. В отсроченной фазе отмечается незначительное накопление контраста капсулой образования. В просвете желудка и тонкой кишки на фоне контрастного содержимого определяются множественные свертки.
Заключение: «разрыв фузиформной аневризмы общей печеночной артерии с прорывом крови в желудок или двенадцатиперстную кишку».
По согласованию пациент переведен в специализированное учреждение, где в результате рецидива профузного желудочно-кишечного кровотечения по экстренным показаниям проводится операция.
Интраоперационно обнаружено аневризматическое расширение печеночной артерии до 5–6 см на протяжении до 5 см, заканчивающееся в месте бифуркации. При ревизии установлено, что имеется дефект стенки аневризмы по нижнему краю, распространяющийся на заднюю стенку желудка в области привратника и начальные отделы ДПК с образованием “дочерней” ложной аневризмы до 4 см, выполненной старыми и свежими свертками. Истинная аневризма общей печеночной артерии резецирована. Общая печеночная артерия протезирована протезом GORE-TEX 10 мм. Полость ложной аневризмы тампонирована прядью большого сальника. Течение послеоперационного периода без осложнений. Больной выписан на 17-е сутки в удовлетворительном состоянии.
Заключение.
Аневризмы печеночных артерий являются редкой патологией, а учитывая скудность и стертость клинической картины, для выявления и верификации данной патологии необходимо применять весь доступный комплекс методов лучевой визуализации. Последовательность применения методов исследования должна соответствовать нарастанию их инвазивности. Ультразвуковое исследование на раннем этапе позволяет без лучевой нагрузки на пациента диагностировать аневризму и оценить сосуд, являющийся её источником. Диагностическая точность компьютерной томографии сопоставима с информативностью традиционной ангиографии и позволяет не только уточнить взаимоотношение аневризмы с окружающими структурами, но и оценить состояние окружающих тканей, вследствие чего разумно использовать её следующим этапом диагностического процесса не только для уточнения диагноза но и для планирования объема оперативного лечения.
Рентгенэндоваскулярное лечение является эффективным методом, позволяющим добиться надежного выключения аневризмы из кровотока, тип вмешательства зависит от топографо-анатомических особенностей аневризмы.
Несвоевременная диагностика данной патологии грозит серьезными осложнениями вплоть до летального исхода.
Интерес представленного клинического наблюдения обусловлен, на наш взгляд, редкой встречаемостью патологии и убедительностью данных полученных с помощью УЗИ и компьютерной томографии.
Литература
- Huang Y. K., Hsieh H. C., Tsai F. C., Chang S. H., Lu M. S. Visceral artery aneurysm: risk factor analysis and therapeutic opinion. Eur J Vasc Endovasc Surg. 2007; 33: 293-301.
- Лесняк В. Н., Кемеж Ю. В., Ермичева А. Ю. КТ-диагностика аневризм висцеральных ветвей брюшной аорты. Российский электронный журнал лучевой диагностики 1: 65-70.
- Guida P. M., Moore S. W. Aneurysm of the hepatic artery. Report of five cases with a brief review of the previously reported cases. Surgery 1966; 60: 299-310.
- Crisp E. A Treatise on the Structure, Diseases and Injuries of the Blood-Vessels With statistical deductions, etc. John Churchil 1847;
- Friedenwald J., Tannenbaum K. Aneurysm of hepatic artery. American Journal of the Medical Sciences 1923; 11-28.
- Oser L., von Neusser E., Quincke H. I., Hoppe-Seyler G. K. F. Diseases of the Liver, Pancreas and Suprarenal Capsules:. Sanders 1905;
- Hale-White W. Common Affections of the Liver. Nisbet 1908;
- Messina L. M., Shanley C. J. Visceral Artery Aneurysms. Surgical Clinics of North America 1997; 77: 425-442.
- Щербюк А., Артюхина Е., Ульянов Д., Фролов К., Зайцев А., Чжао А. Аневризма печеночной артерии как причина механической желтухи. Врач 2007; 12: 65-67.
- Kehr H. Der erste Fall von erfolgreicher Unterbindung der Arteria hepatica propria wegen Aneurysma. Munchen Med Wschr 1903; 1: 1861-1863.
- Gordon-Taylor G. Rare Cause of Severe Gastro-intestinal Haemorrhage. British medical journal 1943; 1: 504.
- Siew S. Aneurysm of the hepatic artery; report of a case and review of the literature. S Afr J Clin Sci 1952; 3: 143-153.
- Barnett W. O., Wagner J. A. Aneurysm of the hepatic arterya cause of obscure abdominal hemorrhage. Annals of surgery 1953; 137: 561.
- Curran F. T., Taylor S. A. Hepatic artery aneurysm. Postgrad Med J 1986; 62: 957-959.
- Ikeda O., Tamura Y., Nakasone Y., Iryou Y., Yamashita Y. Nonoperative management of unruptured visceral artery aneurysms: treatment by transcatheter coil embolization. J Vasc Surg 2008; 47: 1212-1219.
- Квашнин А. И., Атаманов С. А., Мельник А. В., Быков О. А., Помкин А. А., Ширкин М. Г. Эндоваскулярная редукция ложной аневризмы собственной печеночной артерии. Клинический случай. Международный журнал интервенционной кардиоангиологии.
- Abbas M. A., Fowl R. J., Stone W. M., Panneton J. M., Oldenburg W. A., Bower T. C. et al. Hepatic artery aneurysm: factors that predict complications. J Vasc Surg 2003; 38: 41-45.
- Shanley C. J., Shah N. L., Messina L. M. Common splanchnic artery aneurysms: splenic, hepatic, and celiac. Ann Vasc Surg 1996; 10: 315-322.
- Sachdev-Ost U. Visceral artery aneurysms: review of current management options. Mt Sinai J Med 2010; 77: 296-303.
- O'Driscoll D., Olliff S. P., Olliff J. F. Hepatic artery aneurysm. Br J Radiol 1999; 72: 1018-1025.
- Man C. B., Behranwala K. A., Lennox M. S. Ruptured hepatic artery aneurysm presenting as abdominal pain: a case report. Cases J 2009; 2: 8529.
- Huang C-T, Chiu C-Y, Chen K-H, Lee T-H. A Common Hepatic Artery Aneurysm Mimicking A Duodenal Submucosal Tumor Presenting as Upper Gastrointestinal Bleeding: A Case Report. J Int Med Taiwan 2010; 21: 56-61.
- Shaw J. F. Hepatic artery aneurysms. Br J Hosp Med 1982; 28: 407-409.
- Chung-Tsui. C. H. A Common Hepatic Artery Aneurysm Mimicking A Duodenal Submucosal Tumor Presenting as Upper Gastrointestinal Bleeding: A Case Report. 2010; 51-56.
- Athey P. A., Sax S. L., Lamki N, Cadavid G. Sonography in the diagnosis of hepatic artery aneurysms. AJR Am J Roentgenol. 1986; 147: 725-727.
- Saad N. E., Saad W. E., Davies M. G., Waldman D. L., Fultz P. J., Rubens D. J. Pseudoaneurysms and the role of minimally invasive techniques in their management. Radiographics 2005; S173-189.
- Katyal S., Oliver J. H., 3rd, Buck D. G., Federle M. P. Detection of vascular complications after liver transplantation: early experience in multislice CT angiography with volume rendering. AJR Am J Roentgenol. 2000; 175: 1735-1739.
- Molina J. A., Benito Santamaría V., Guerrero R., Babun Y. Spectrum of CT Angiography Findings of Pseudoaneurysm. ECR 2013;
- Soto J. A., Munera F., Morales C., Lopera J. E., Holguin D., Guarin O. et al. Focal arterial injuries of the proximal extremities: helical CT arteriography as the initial method of diagnosis. Radiology 2001; 218: 188-194.
- Затевахин И. И., Цициашвили М. Ш., Золкин В. Н., Сидельцева А. А. Разрыв аневризмы печеночной артерии с формированием дуоденальной фистулы.
- Carr S. C., Mahvi D. M., Hoch J. R., Archer C. W., Turnipseed W. D. Visceral artery aneurysm rupture. J Vasc Surg 2001; 33: 806-811.
- Wojtaszek M. Managing Visceral Artery Aneurysms. Endovascular today. 2013; 10: 77-81.
- Таразов П. Г., Рыжиков В. К., Полысалов В. Н., Прозоровский К. В., Поликарпов А. А. Безуспешная эмболизация аневризмы общей печеночной артерии. Хирургия 1998; 8: 54-55.
- Тимербулатов В. М., Тимербулатов М. В., Ишметов В. Ш., Чудновец Л. Г., Мустафакулов У. С. Аневризмы висцеральных артерий брюшной полости. Клиническая и экспериментальная хирургия.
- Щербюк А., Артюхина Е., Ульянов Д., Фролов К., Зайцев А., Чжао А. Аневризма печеночной артерии как причина механической желтухи.